No hay productos en el carrito.
En la entrada de hoy nos sumergiremos en el último grupo de fracturas periprotésicas de rodilla, las de femur. Estas son las más estudiadas en la literatura debido a su mayor incidencia e importancia clínica. Su frecuencia oscila entre 0,3-7,8%, siendo de 0,3 a 2,5% en las artroplastias primarias, aumentado de 1,6 a 38% en las cirugías de revisión.
Las fracturas periprotésicas de femur son aquellas que se producen en los 15 cm proximales a la interlínea articular, o en los 5 cm adyacentes a la punta del vástago del implante (23). Pueden producirse durante la intervención, en el postoperatorio inmediato, aunque de media se producen entre los 2-4 años de la intervención (24).
Los factores de riesgo son:
- Osteoporosis (es el factor más importante); siendo más frecuentes en mayores de 70 años y en mujeres (4 de cada 5).
- Enfermedades inflamatorias.
- Uso crónico de corticoides.
- Enfermedades neurológicas.
- Rigidez articular (artrofibrosis).
- Manipulación bajo anestesia.
- Prótesis navegadas (por la existencia de agujeros de los pines).
- Osteolisis peri implante.
- Uso de vástagos largos y prótesis constreñidas.
- Cirugía de revisión.
- Los defectos corticales anteriores (notching) son controvertidos como causa predisponente de fractura (mayor de 3 mm o diámetro mayor de 1 cm), encontrando en la literatura argumentos tanto a favor (25) como en contra (26).
- No existe tampoco una relación clara entre el malalineamiento protésico y la producción de fracturas (5).
Caso de notching anterior
Un solo factor asociado no suele tener gran trascendencia siendo la combinación de varios la que realmente aumenta el riesgo.
Los déficits de movilidad vienen definidos por dos mecanismos:
- Por tratarse de pacientes con mayor tendencia a sufrir caídas, debido a su menor movilidad y agilidad.
- Por tener una menor capacidad de disipar la energía de la caída y un mayor brazo de palanca.
Estas fracturas se producen por la combinación de mecanismos de carga axial y torsional (15).
En la mayor parte de los casos suelen ser secundarias a caídas de baja velocidad, seguidas por los accidentes de tráfico, las manipulaciones bajo anestesia para el tratamiento de la rigidez postquirúrgica, y por las convulsiones (27).
Las fracturas intraoperatorias suponen un 19%, y no suelen ser desplazadas ni conminutas, y no suelen asociar lesiones de partes blandas.
Pueden clasificarse en diafisarias o metafisarias:
- Las diafisarias suelen producirse durante la inserción de la guía de alineación intramedular y suelen pasar desapercibidas
- Las metafisarias tienen lugar en la zona de transición entre el hueso metafisario y el diafisario.
Existen distintas clasificaciones, aunque ninguna goza de una aceptación universal: Neer, DiGioia y Rubash, Chen, Rorabeck y Taylor, y Backstein.
La clasificación de Neer se basa en el desplazamiento de la fractura y la estabilidad del implante. Pero no tiene en cuenta la relación del hueso con la prótesis.
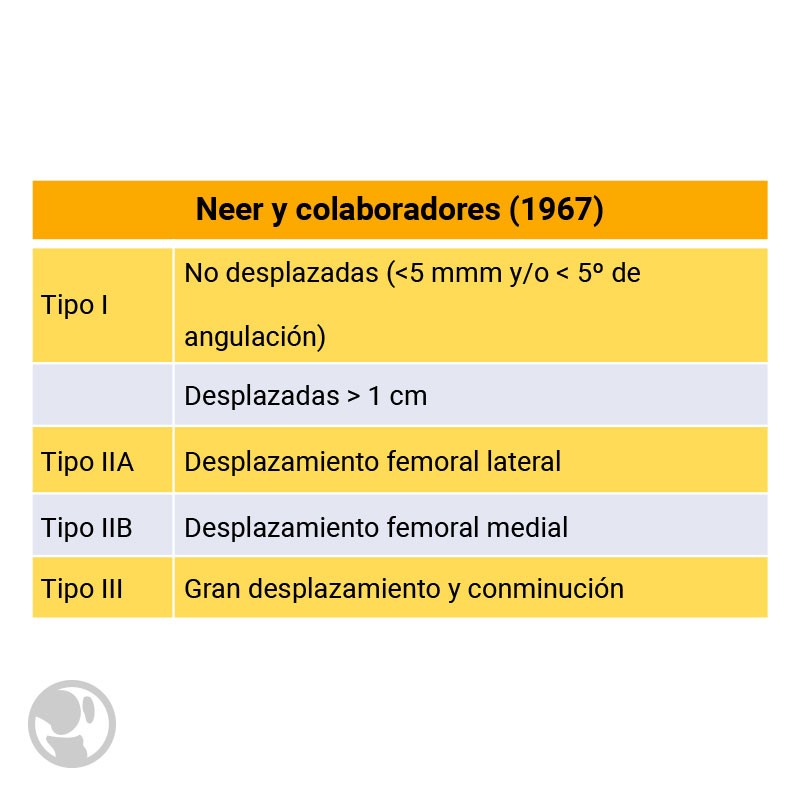
Clasificación de Neer de las fracturas periprotésicas de rodilla.
Esto motivó la modificación inicialmente por Digoia y posteriormente por Rorabeck. Actualmente la clasificación de Rorabeck es la más utilizada. Las divide en tres categorías:
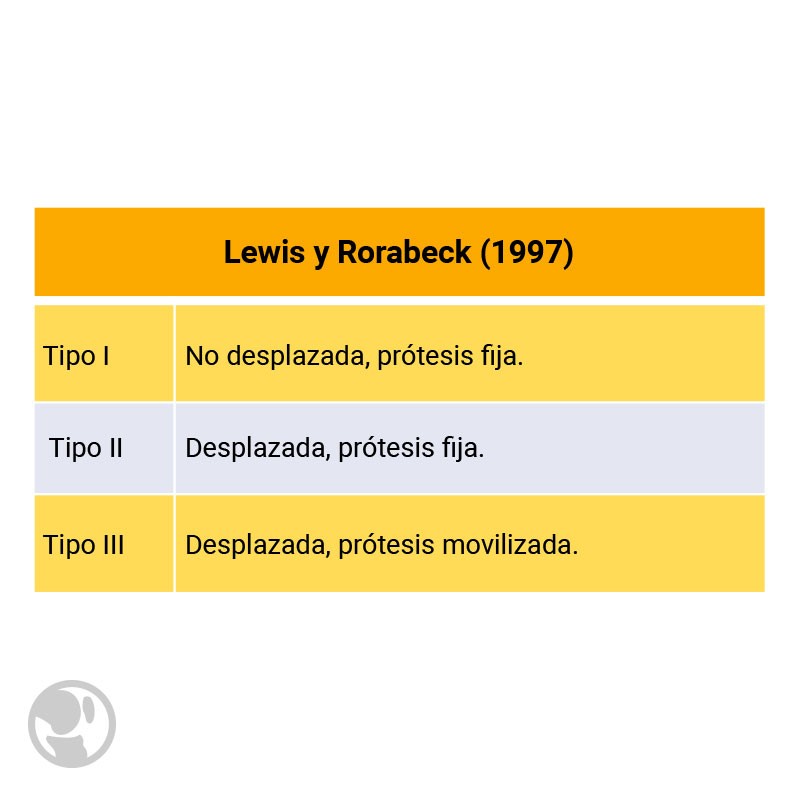
Clasificación de Lewis y Rorabeck.
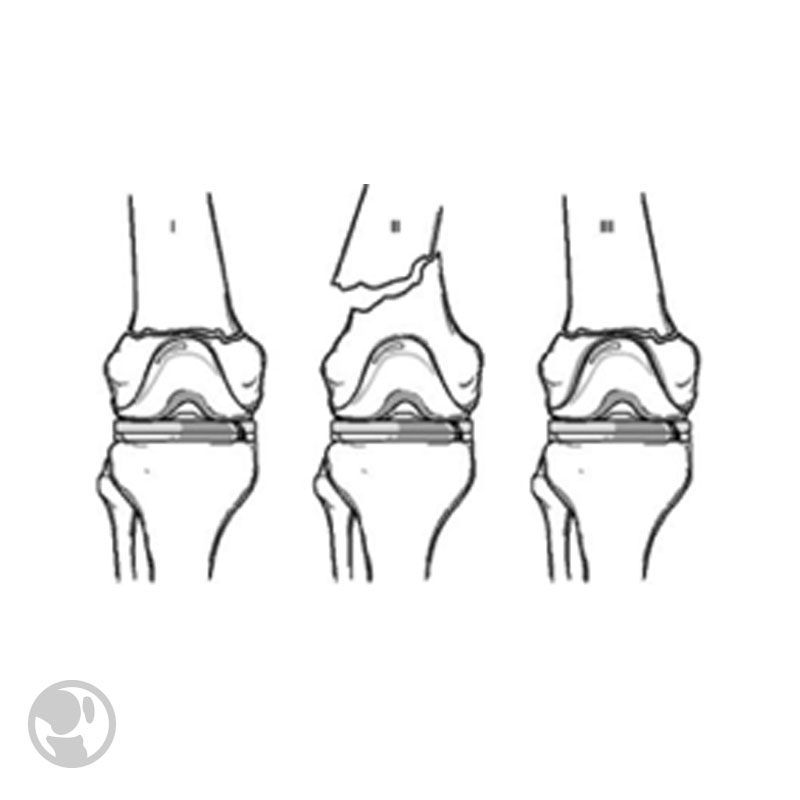
Clasificación de Lewis y Rorabeck
La limitación de esta clasificación es la dificultad para definir el tipo de tratamiento según el tipo de fractura. Por esta razón, Kim propuso su clasificación basada en el stock óseo, el desplazamiento, el grado de fijación y la reductibilidad de la fractura.

Clasificación de Kim
El objetivo del tratamiento es la restitución del paciente a su actividad prelesional. En un gran número de casos no se consigue.
Para algunos autores, el objetivo es más modesto incluyendo la consolidación de la fractura, sin dolor, un arco de movilidad de 0-90º, una prótesis estable, y la persistencia de la capacidad de deambular. Rorabeck definía como aceptables acortamientos menores de 2 cm, y mal alineamientos de 5º en el eje varo/valgo y 10º en ante/recurvatum.
El tratamiento en pacientes con fracturas reducidas y estables, con buen hueso, debe ser conservador.
El tratamiento conservador se reserva también para pacientes no susceptibles de tratamiento quirúrgico por causas médicas y las fracturas no desplazadas sin afectación intercondílea.
Las opciones de tratamiento conservador incluyen la tracción transesquelética y la inmovilización rígida con yesos u ortesis durante un período de 4-6 semanas.
Un meta análisis realizado por Chen mostraba que suelen proporcionar buenos resultados (83%) similares a los del tratamiento quirúrgico (84%).
A continuación se muestras cuatro figuras del Tratamiento conservador de fractura tipo IA.
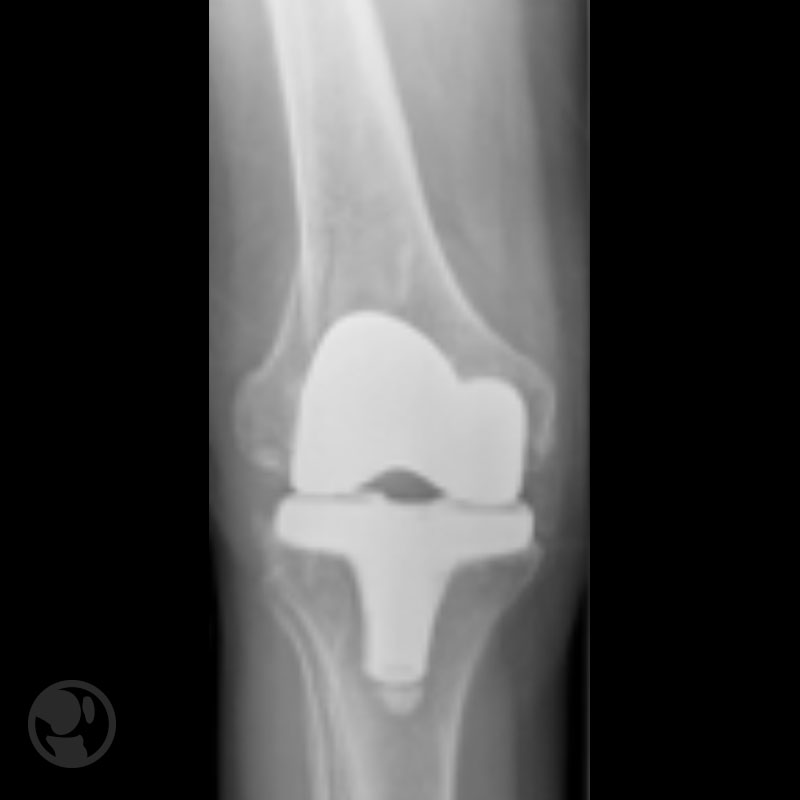
Tratamiento conservador de fractura tipo IA
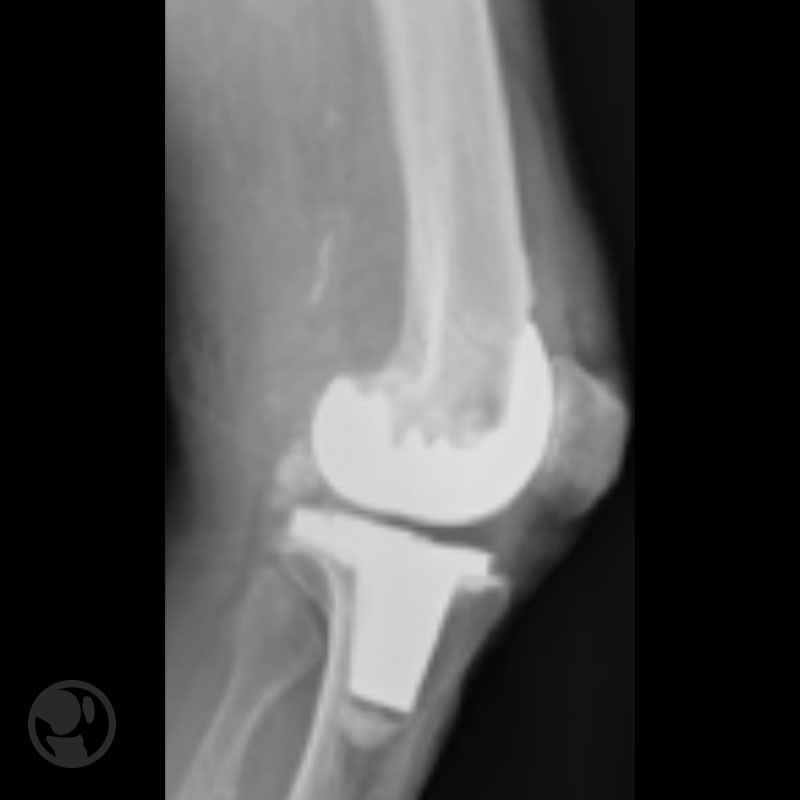
Tratamiento conservador de fractura tipo IA
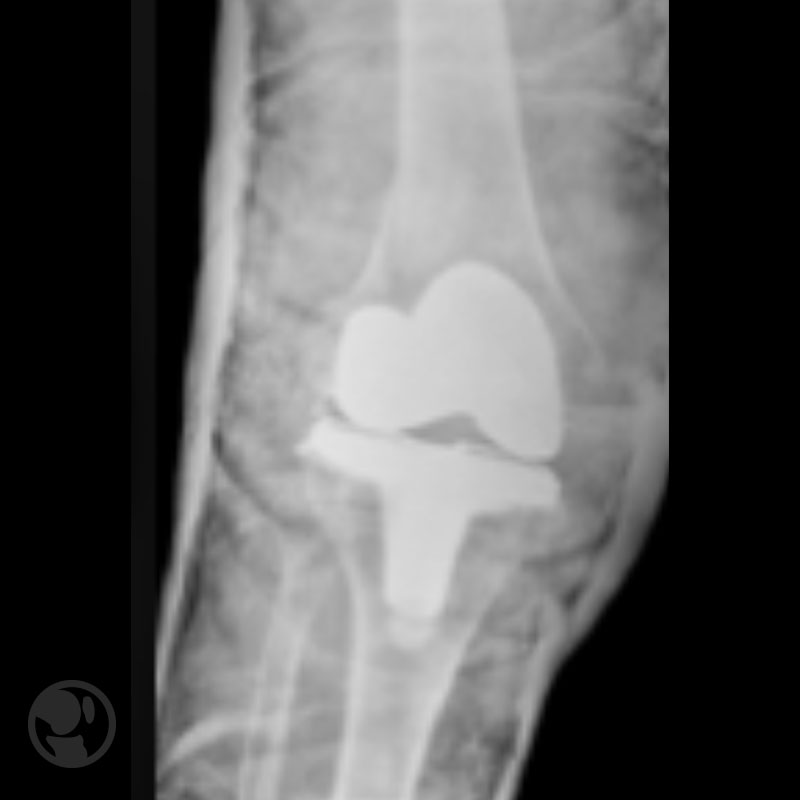
Tratamiento conservador de fractura tipo IA
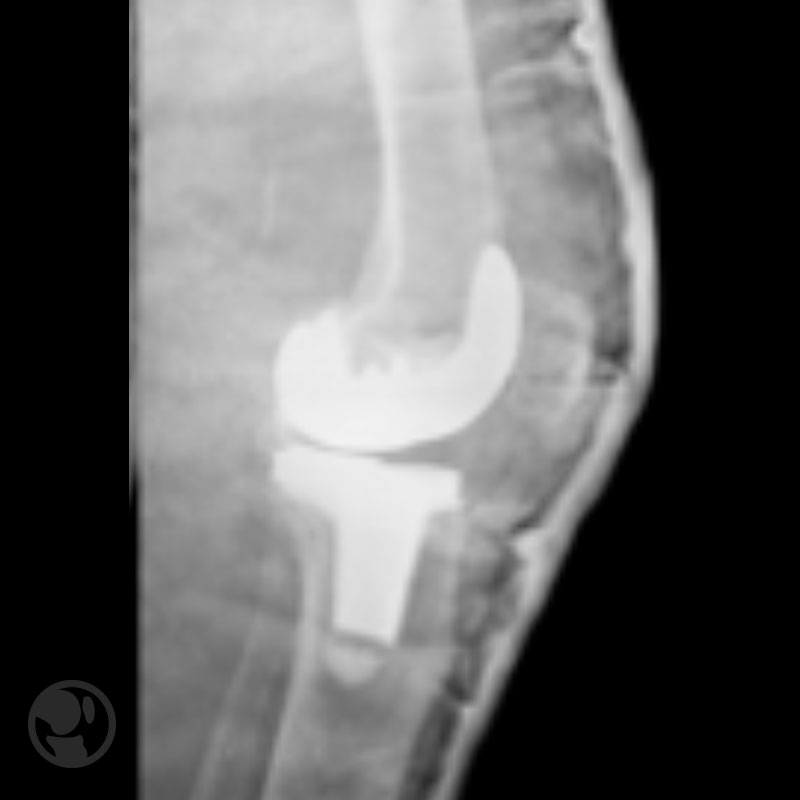
Tratamiento conservador de fractura tipo IA
Las desventajas de este tipo de tratamiento son la dificultad para conseguir y mantener la reducción de la fractura, lo cual produce una alta tasa de complicaciones (40%) como pseudoartrosis y consolidaciones viciosas, así como una notable disminución de la movilidad. Además hay que asumir el alto riesgo de complicaciones asociadas con el reposo prolongado en pacientes mayores (neumonía, TEP, intensa atrofia muscular, decúbito, etc.).
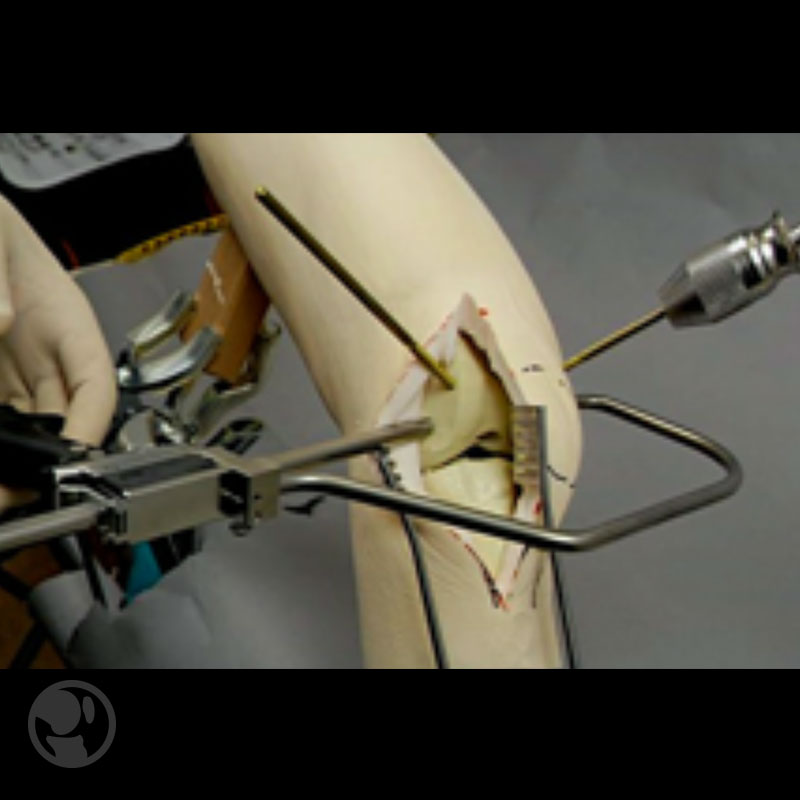
Si se descubre una fractura intraoperatoria, se debe utilizar una prótesis con vástago largo que sobrepase la penetración cortical en por lo menos dos diámetros del canal. Idealmente, el vástago debe ser aflautado para mejorar la estabilidad rotacional, y no estar cementado a nivel del foco de fractura para no alterar la consolidación. Si la fractura está desplazada, se debe aumentar la estabilidad con tornillos intercondilares para mantener la alineación. Si el descubrimiento de la fractura es posterior, debe evitarse la carga completa durante 6-8 semanas.
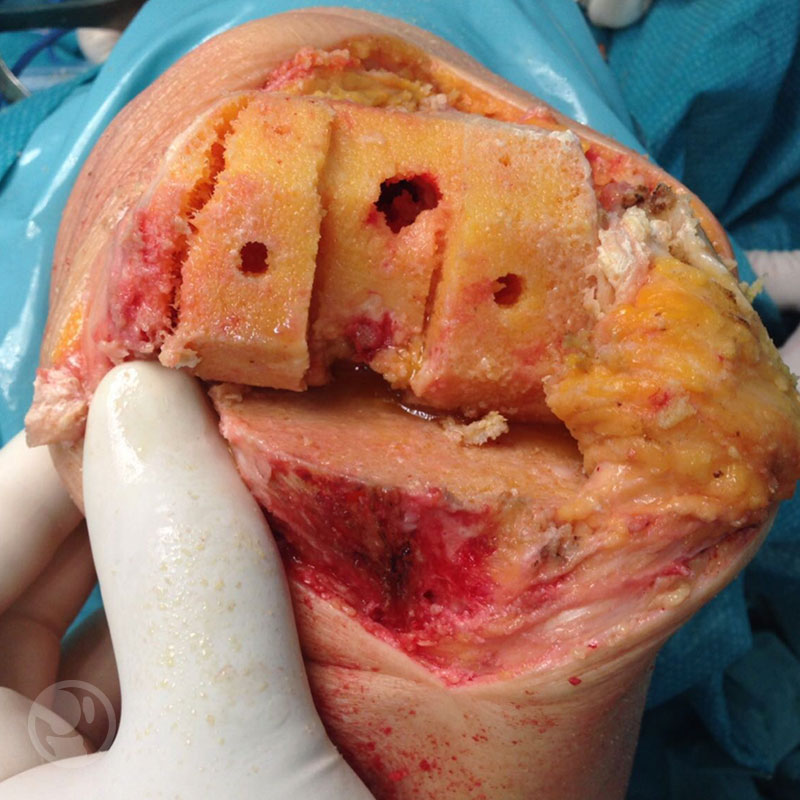
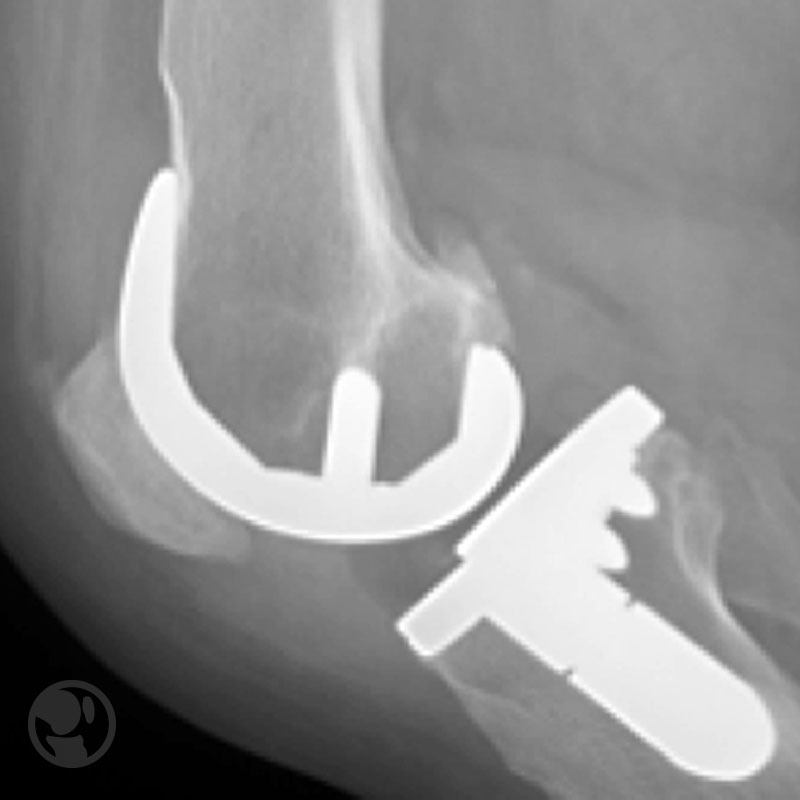
Fractura intraoperatoria del cóndilo femoral interno tratada mediante RAFI con tornillos.
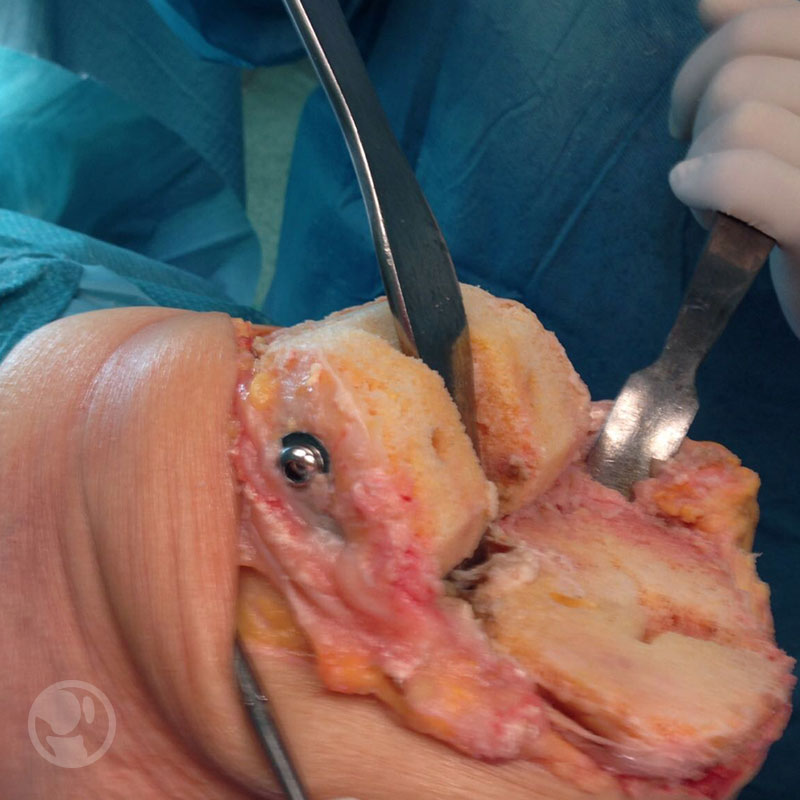
Fractura intraoperatoria del cóndilo femoral interno tratada mediante RAFI con tornillos.
En las fracturas postoperatorias, que son más frecuentes, la estrategia de tratamiento vendrá definida por la localización, el desplazamiento, la calidad del hueso, y la estabilidad y posicionamiento de la prótesis.
Las fracturas inestables con prótesis fijas suponen la mayor parte. Se indica la reducción y la fijación estable. Dentro de las técnicas disponibles se incluyen las placas condíleas, lo clavos intramedulares, artroplastia de revisión, fijadores externos, cerclajes, injertos óseos y artrodesis.
Las placas convencionales presentan como ventaja el hecho de que ayudan a la reducción de la fractura, y tienen una buena relación coste-beneficio. Como inconvenientes figuran la necesidad de disponer de un hueso de buena calidad, que sólo pueden usarse en patrones simples de fractura, y la necesidad de vías de abordaje amplias, con la consiguiente lesión de partes blandas.
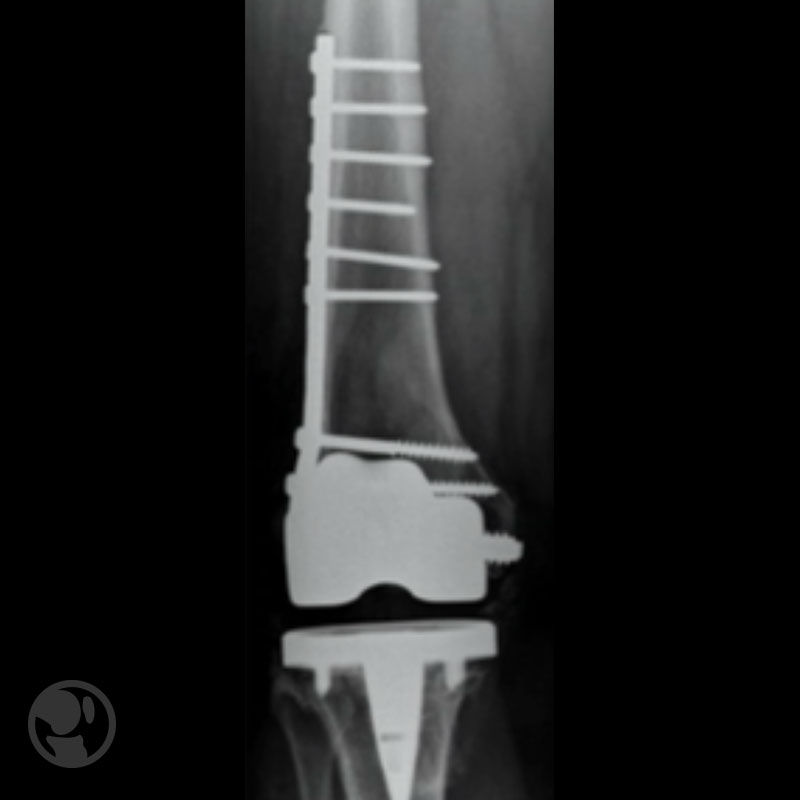
Osteosíntesis con clavo-placa tipo DCS de prótesis tipo Natural Knee
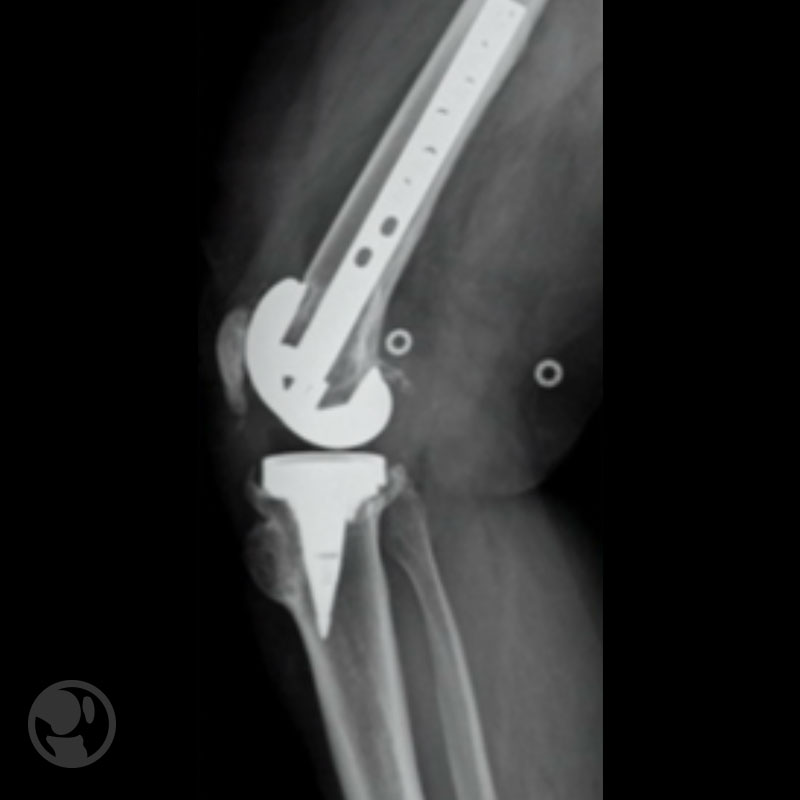
Osteosíntesis con clavo-placa tipo DCS de prótesis tipo Natural Knee
La mejoría en los sistemas de osteosíntesis menos invasivos y con mejor fijación en hueso de mala calidad proporcionan una mejora notable de los resultados (clavos endomedulares retrógrados y placas de estabilidad angular).
Estos métodos presentan una morbilidad menor y permiten una recuperación más rápida de los pacientes, aunque la tasa de complicaciones se sitúa en el 40%.
El uso de las placas tipo LISS presenta la ventaja de minimizar la lesión de partes blandas al poderse implantar con técnica percutánea; y mejorar la capacidad de fijación, sobre todo si el hueso es osteoporótico. Al ser placas anatómicas facilitan la reducción de la fractura, proporcionando una fijación biológica. Como inconvenientes, son técnicamente muy demandantes, sólo permiten realizar una carga parcial (fijación mono cortical) y son caras.
Placa LISS e instrumental para técnica percutánea.
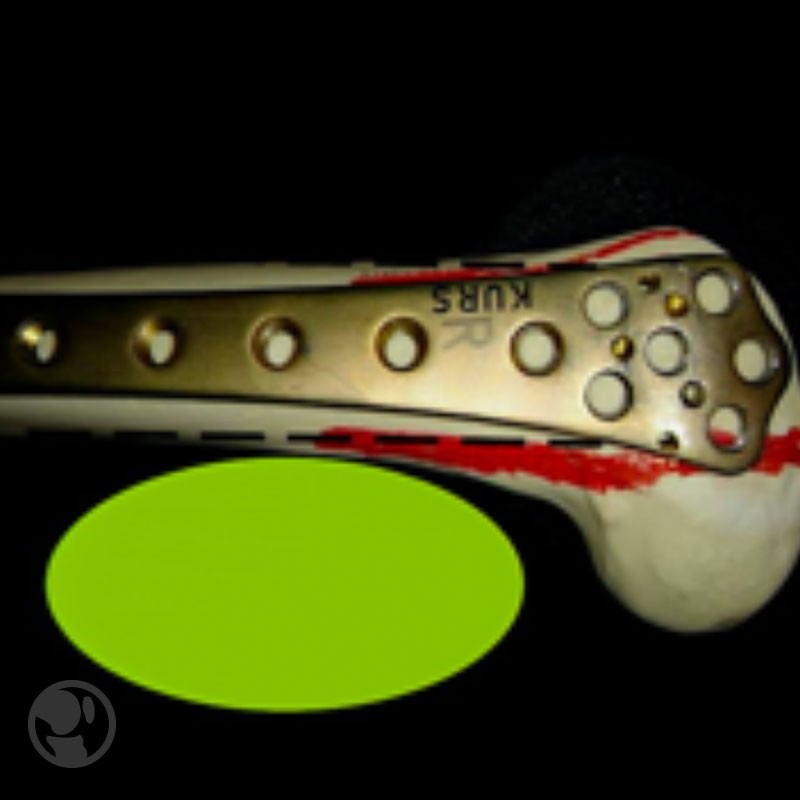
Placa LISS e instrumental para técnica percutánea.
La primera serie fue comunicada por Kregor en 20012, que ya mostró los excelentes resultados verificados en publicaciones posteriores. Disminuyen la necesidad de injertos óseos, el riesgo de infección y la pérdida sanguínea.
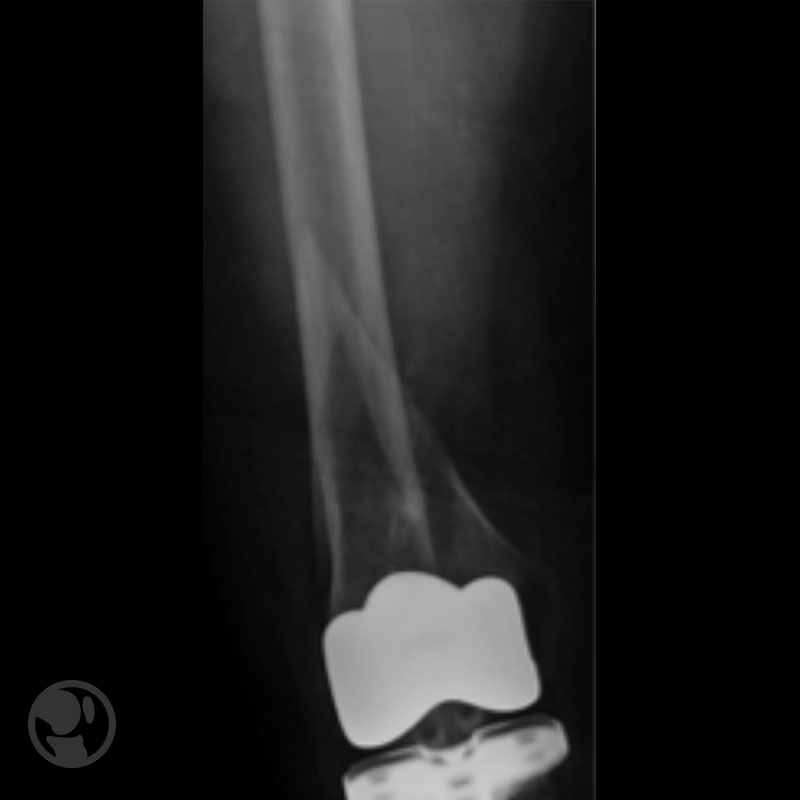
Tratamiento mediante uso de placa LISS tipo IB sobre prótesis tipo Nexgen
Tratamiento mediante uso de placa LISS tipo IB sobre prótesis tipo Nexgen
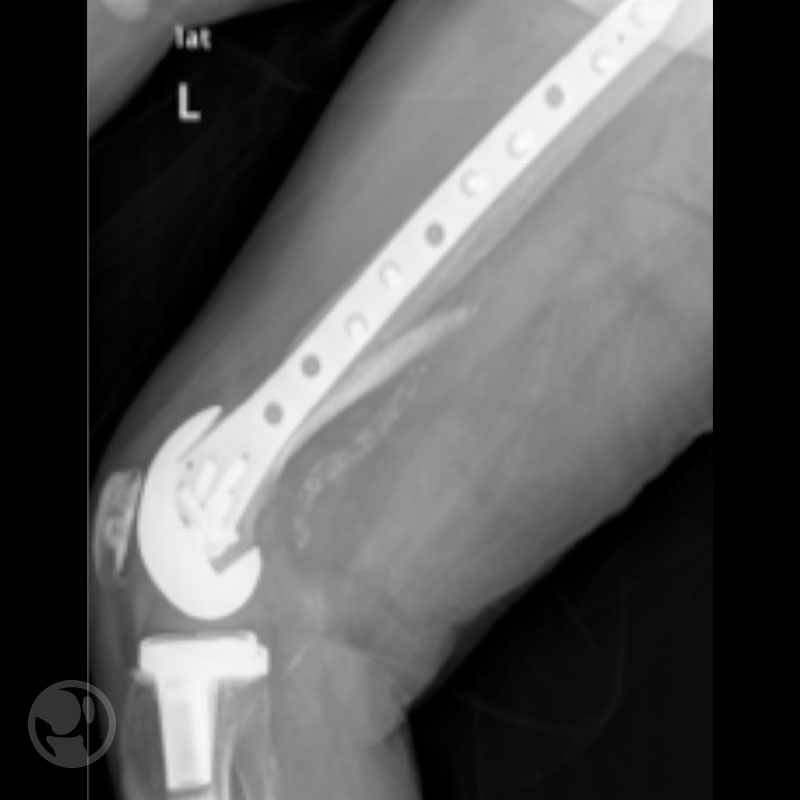
Tratamiento mediante uso de placa LISS tipo IB sobre prótesis tipo Nexgen

Tratamiento mediante uso de placa LISS tipo IB sobre prótesis tipo Nexgen
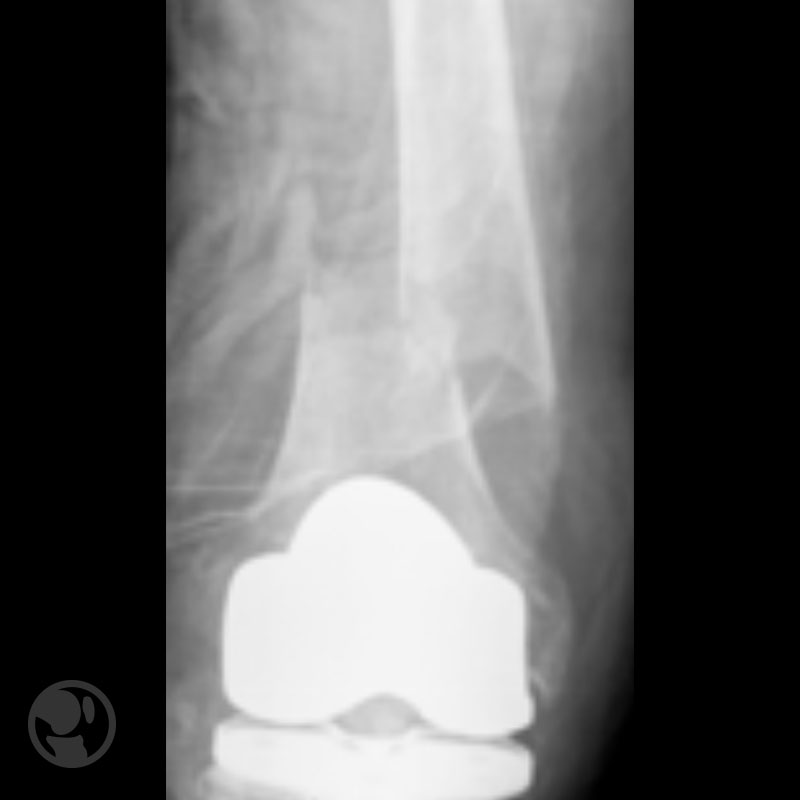
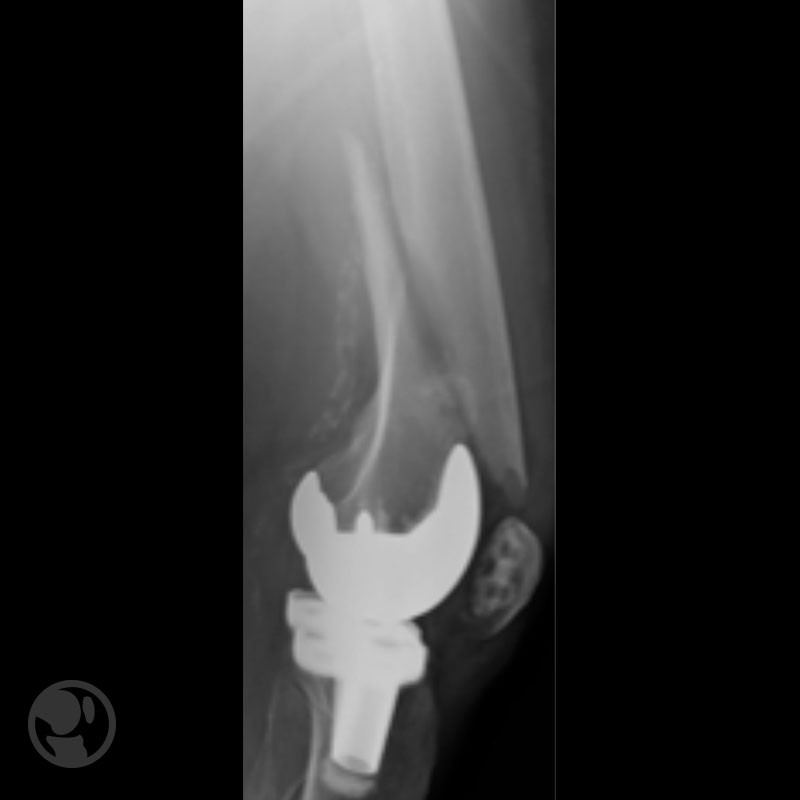
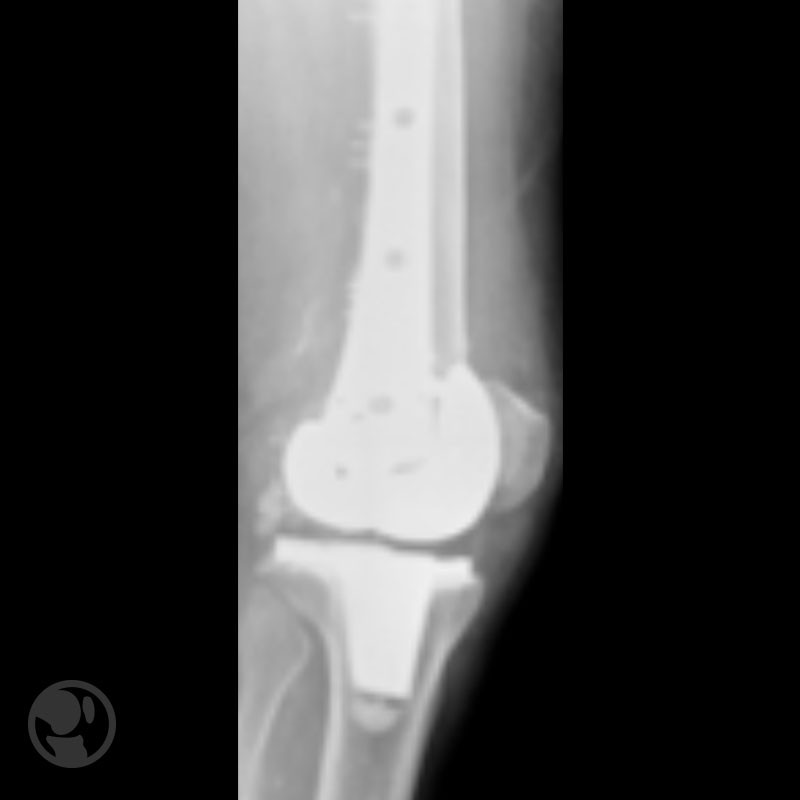
Otro caso de fractura tratada con LISS sobre prótesis tipo Nexgen
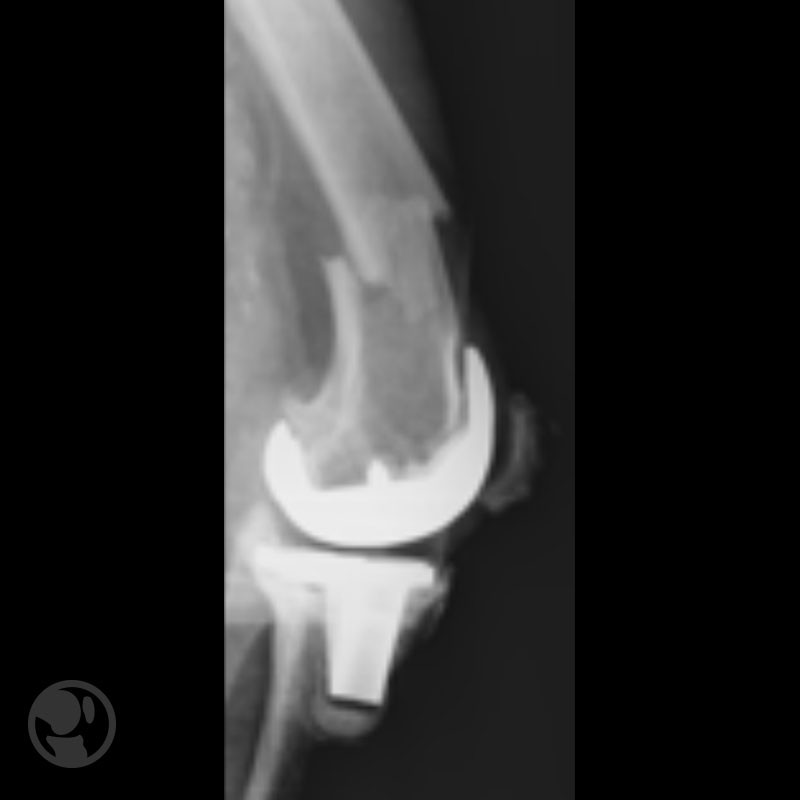
Otro caso de fractura tratada con LISS sobre prótesis tipo Nexgen
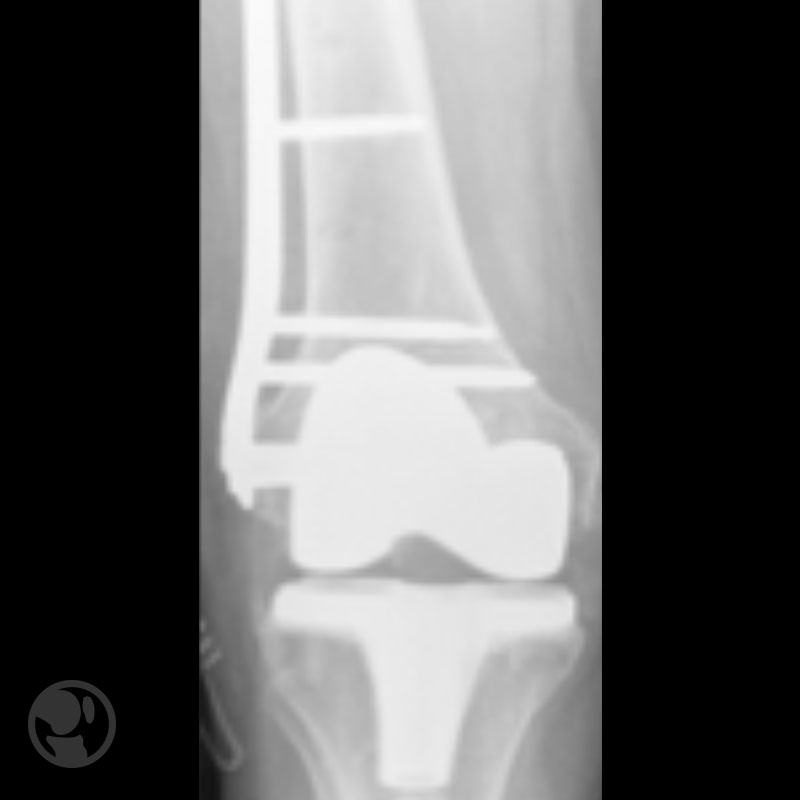
Otro caso de fractura tratada con LISS sobre prótesis tipo Nexgen
Otro caso de fractura tratada con LISS sobre prótesis tipo Nexgen
Otro caso de fractura tratada con LISS sobre prótesis tipo Nexgen
Cuando tenemos una prótesis no posteroestabilizada con un buen stock óseo distal, al menos 8 cm de fragmento distal, que sea estable y esté bien alineada, el tratamiento de elección será el clavo endomedular, gracias a su inmejorable capacidad de transmitir carga por su mayor estabilidad mecánica, lo cual permite la carga inmediata, menor pérdida sanguínea, menor afectación del hematoma fracturario, técnica mínimamente invasiva y un tiempo quirúrgico menor. La primera serie fue publicada en 1994 por Hirsh.
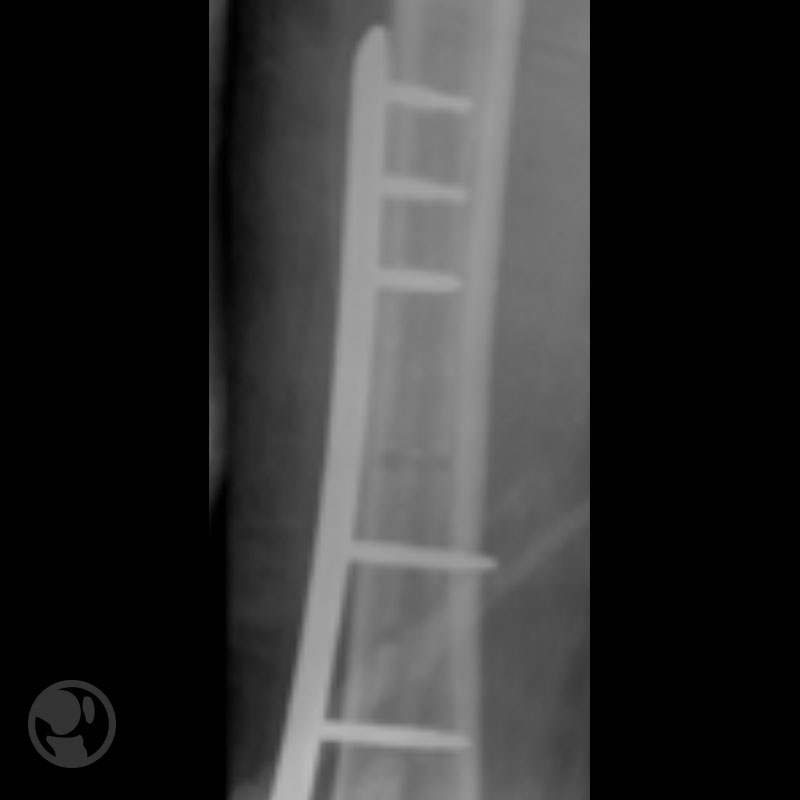
Otro caso de fractura tratada con clavo anterógrado
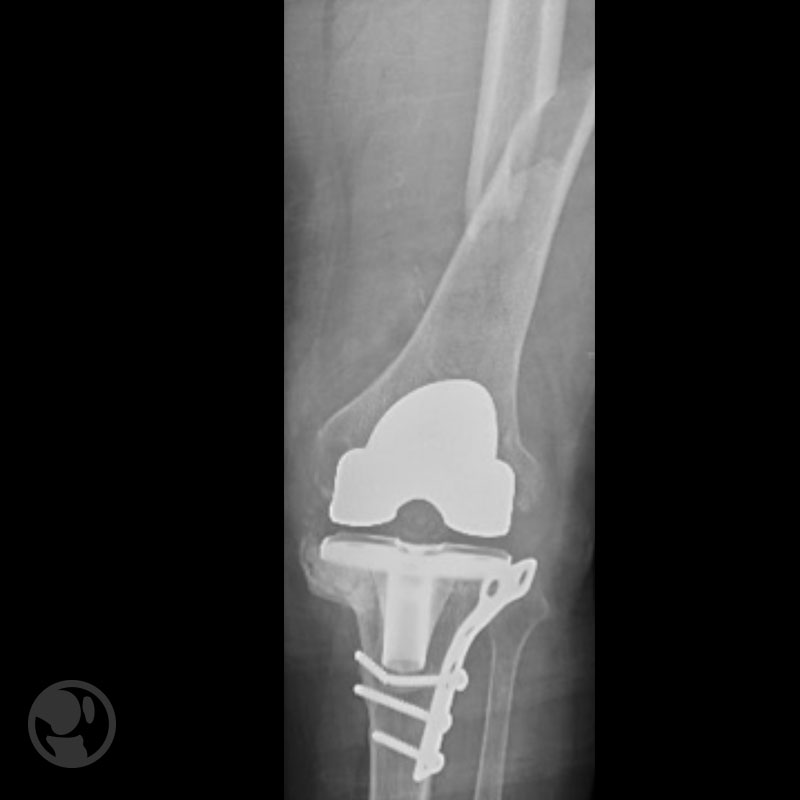
Otro caso de fractura tratada con clavo anterógrado
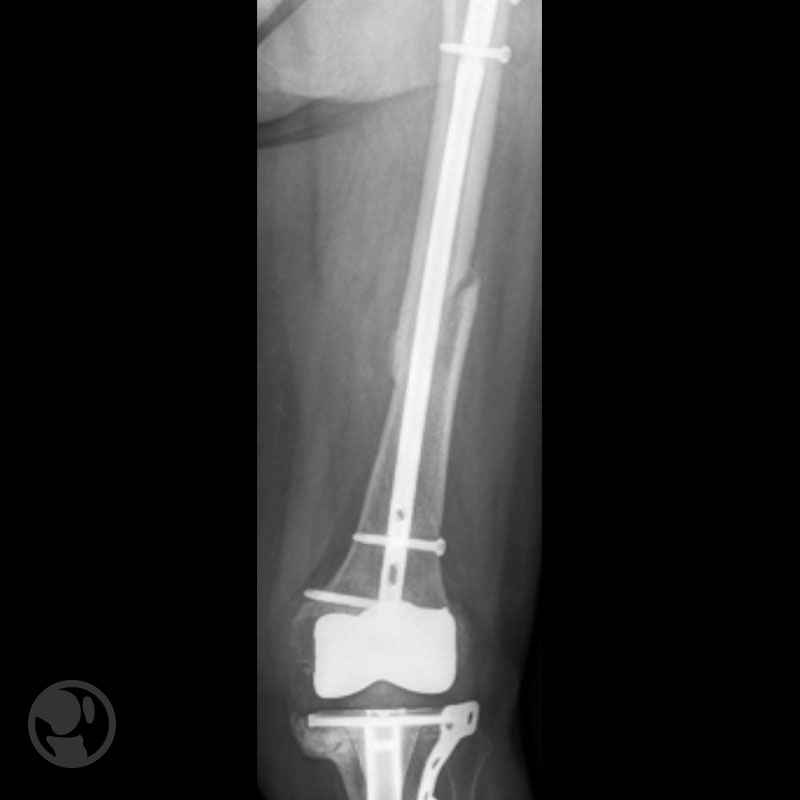
Otro caso de fractura tratada con clavo anterógrado
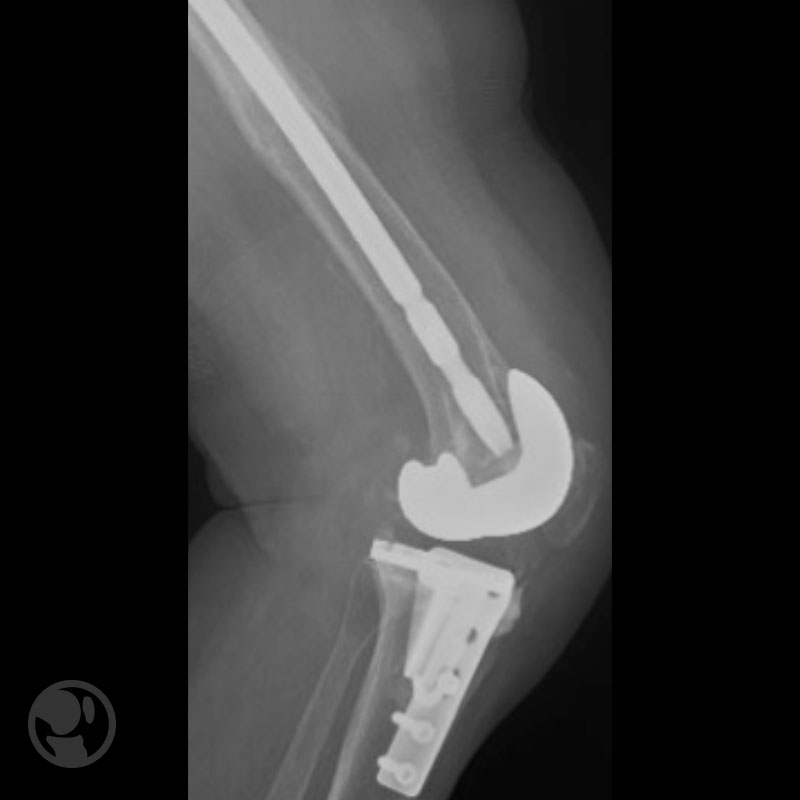
Otro caso de fractura tratada con clavo anterógrado
Los clavos presentan dos desventajas: una por diseño, ya que no son útiles en trazos muy distales por no tener agarre los tornillos; y tener una limitación de uso en prótesis tipo PS, ya que condicionan una entrada más posterior del clavo, induciendo una deformidad a nivel del foco de fractura; e imposibilitan o dificultan la colocación de la espira/tornillos distales.
Descubre el Skill «Fibrosis post-quirúrgica de rodilla»
Pulsa la foto para acceder
“La fibrosis de rodilla, si bien no es una patología frecuente, es muy importante saber como actuar ante ella, más que importante, es básico. Lo más importante ante la fibrosis es saber en que momento debemos actuar. Es importante reconocer controles y consultas externas, para poder determinar en que momento hay que actuar. Demorar una actuación, no va a mejorar el resultado…”
La segunda es la dificultad para conseguir reducciones anatómicas. Se contraindica su uso en prótesis aflojadas, conminutas y fracturas muy distales.

Distintos tipos de escotadura en PTR
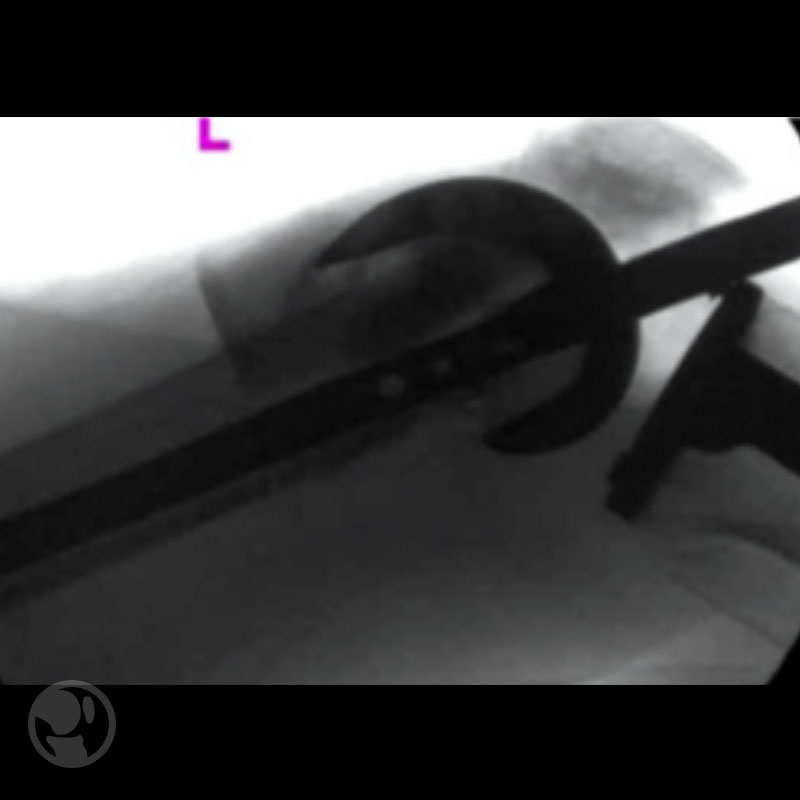
Punto de entrada de clavo posterior
Por ello es útil disponer de la información relativa a cada implante.
https://es.scribd.com/doc/29415615/Orthopaedic-Device-Reference
Técnicamente es fundamental reducir primero la fractura, usar los dos tornillos distales, implantes de ángulo estable, clavos largos (hasta zona subtrocantérea).
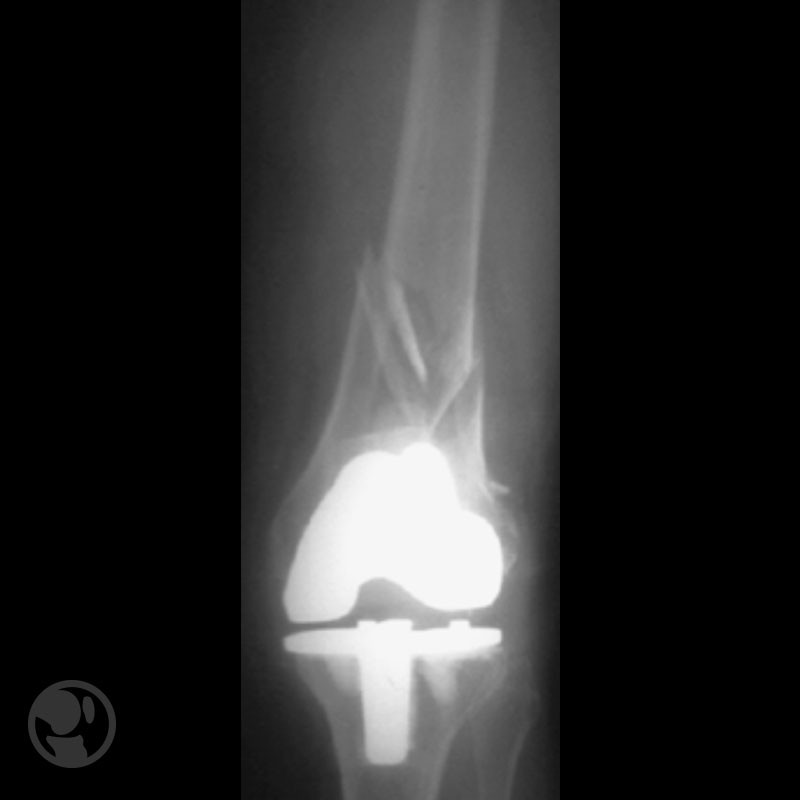
Fractura tratada mediante clavo
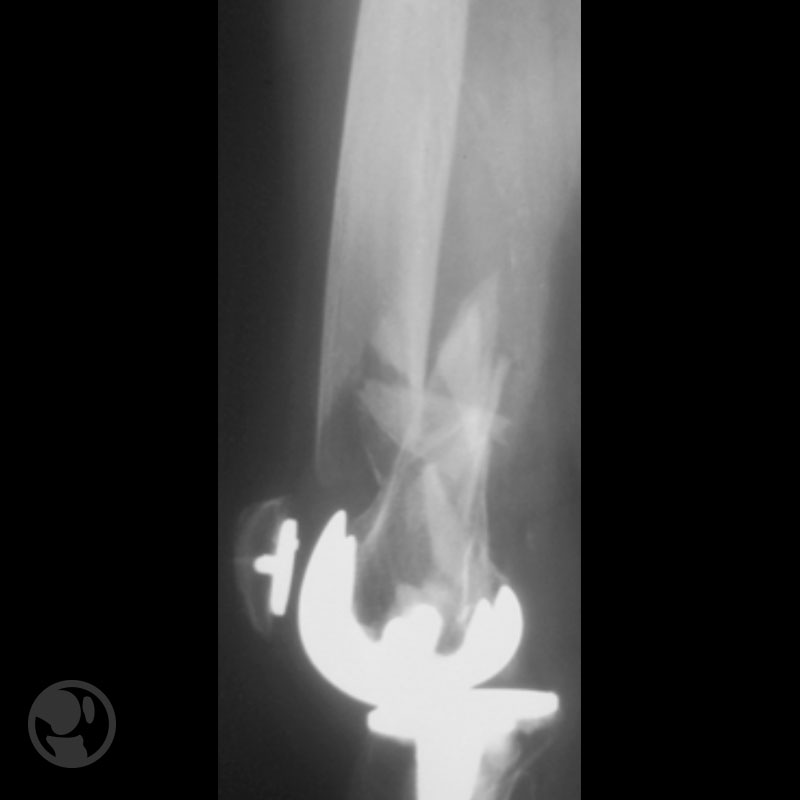
Fractura tratada mediante clavo
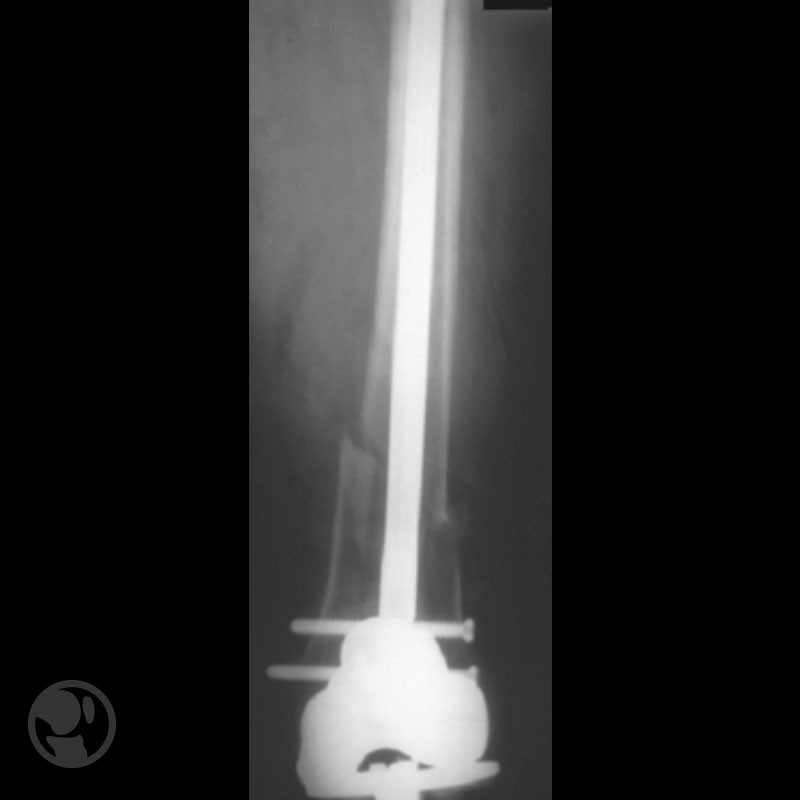
Fractura tratada mediante clavo
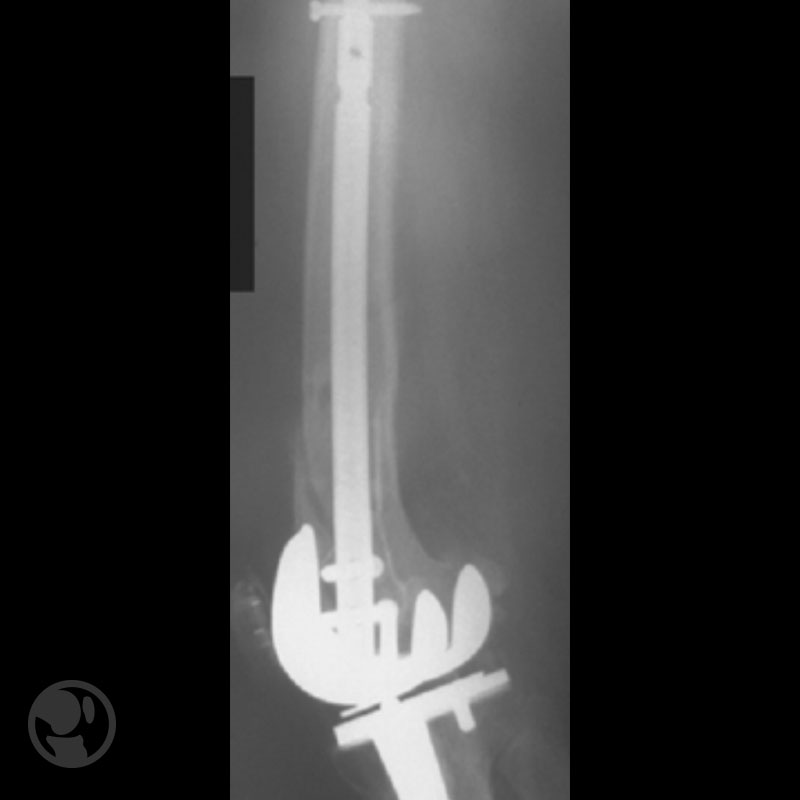
Fractura tratada mediante clavo
Como complicaciones se describen:
- Tendencia al varo y recurvatum de la fractura.
- Mayor riesgo de infección intraarticular.
- Aflojamiento de los tornillos de bloqueo con migración intraarticular del clavo.
- Pseudoartrosis.
- Limitación de la movilidad.
- También se han descrito la metalosis y el desgaste acelerado del polietileno (29).
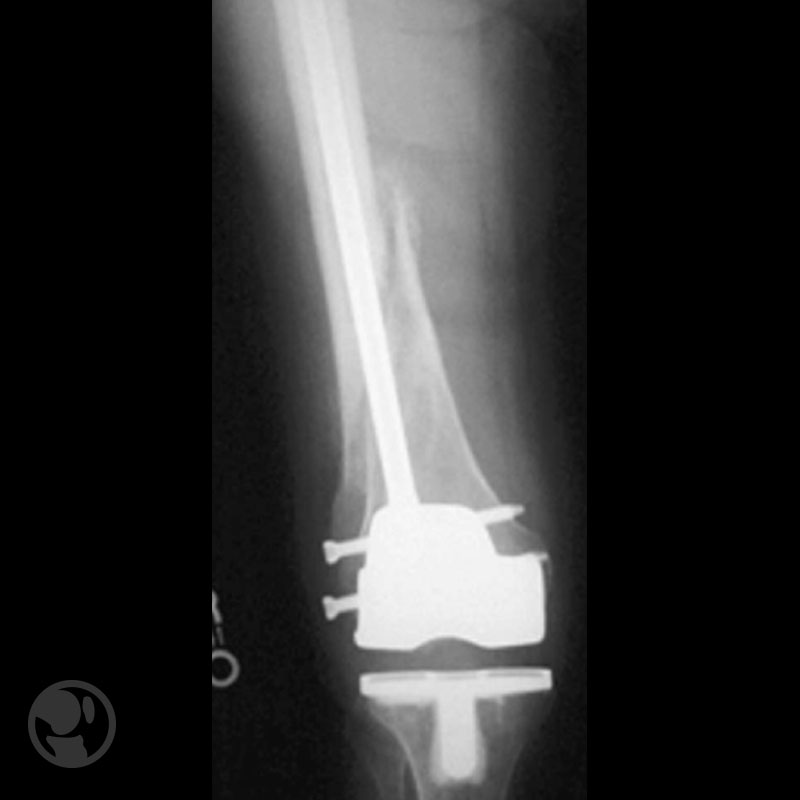
Dos casos de malas reducciones; varo/recurvatum el primero; traslación/varo/recurvatum el segundo
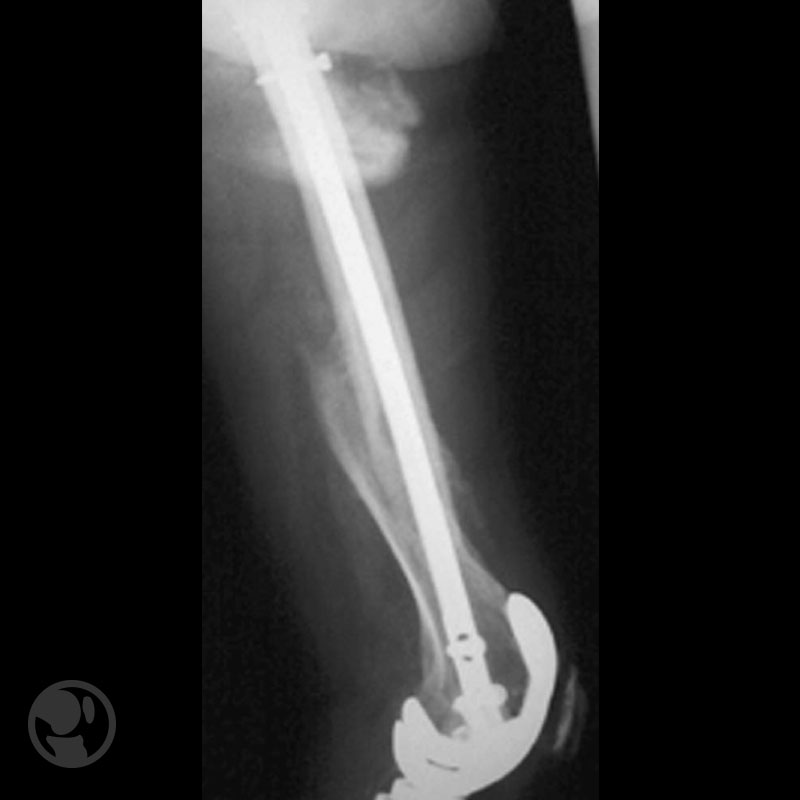
Dos casos de malas reducciones; varo/recurvatum el primero; traslación/varo/recurvatum el segundo
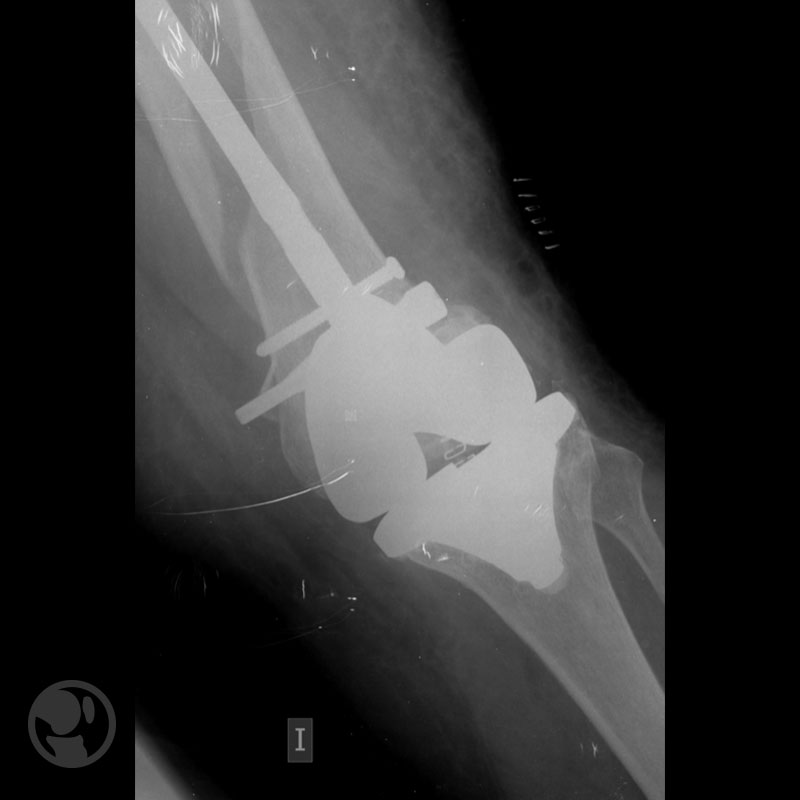
Dos casos de malas reducciones; varo/recurvatum el primero; traslación/varo/recurvatum el segundo
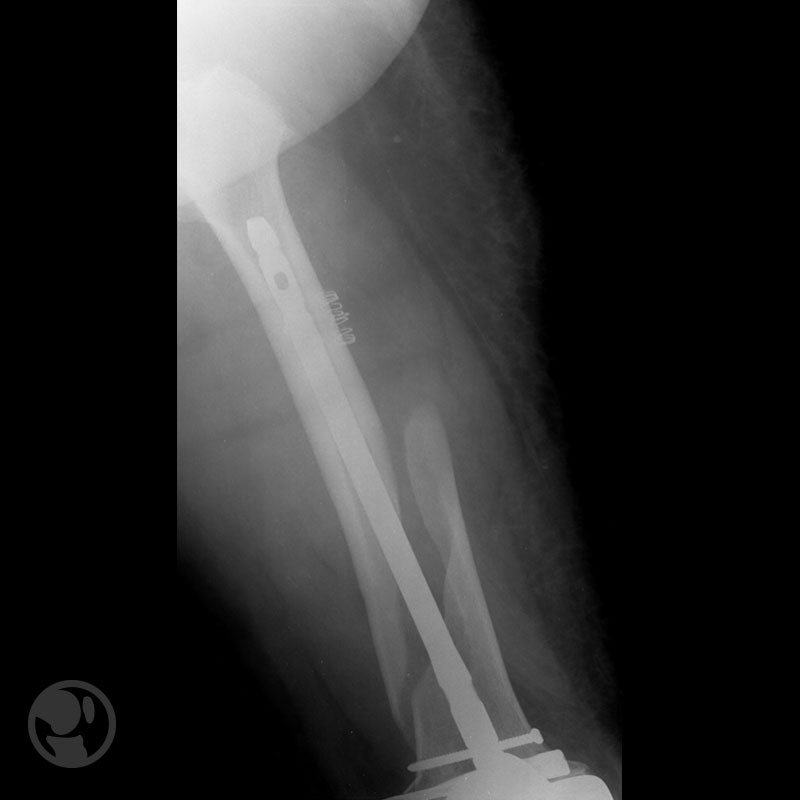
Dos casos de malas reducciones; varo/recurvatum el primero; traslación/varo/recurvatum el segundo
La existencia de conminución y osteoporosis avanzada ha llevado a distintos autores a recomendar el uso de injertos óseos o cementado asociados a la osteosíntesis.
Las fracturas con el componente suelto son las más infrecuentes y las pérdidas óseas las clasifican en el tipo 3. El tratamiento es realizar un recambio con vástagos de revisión y uso de cerclajes, injertos, cuñas, o placas asociadas.
Las fracturas con el componente femoral suelto con pérdida ósea motivan el recambio del fémur distal planteando la posibilidad de utilizar injertos masivos o prótesis tumorales dependiendo de las características de los pacientes.
En pacientes jóvenes es mejor el injerto, teniendo en cuenta el mayor tiempo de consolidación, lo cual implica una limitación funcional durante al menos 6 meses. Si se consigue la consolidación, a medio término los resultados son mejores (30). Se permite asimismo la fijación de la cápsula y ligamentos al injerto, posibilitando el uso de una prótesis semiconstreñida.
En los pacientes mayores, con patología asociada, o con problemas que cuestionen el cumplimiento terapéutico, se recomienda el uso de implantes tipo charnela. Estas prótesis se asocian a resultados a medio o largo plazo con una alta incidencia de complicaciones tipo osteolisis, rotura o nuevas fracturas. Si se produce una infección, la solución es la amputación.
Debido a la rapidez de recuperación, se puede aplicar a otros tipos en los cuales el paciente no puede estar inmovilizado.
Las fracturas que se producen alrededor de las puntas de los vástagos de revisión plantean serios problemas. Limitan el uso de los materiales convencionales de fijación. Se puede realizar el recambio por vástagos más largos, uso de placas corticales, placas LISS, placas con cerclajes. Las complicaciones son frecuentes con las técnicas mínimamente invasivas (0-12,5%) y con los abordajes abiertos (7-29%), aunque no es posible la comparación directa por el uso de distintas estrategias, implantes y tipos de fracturas.
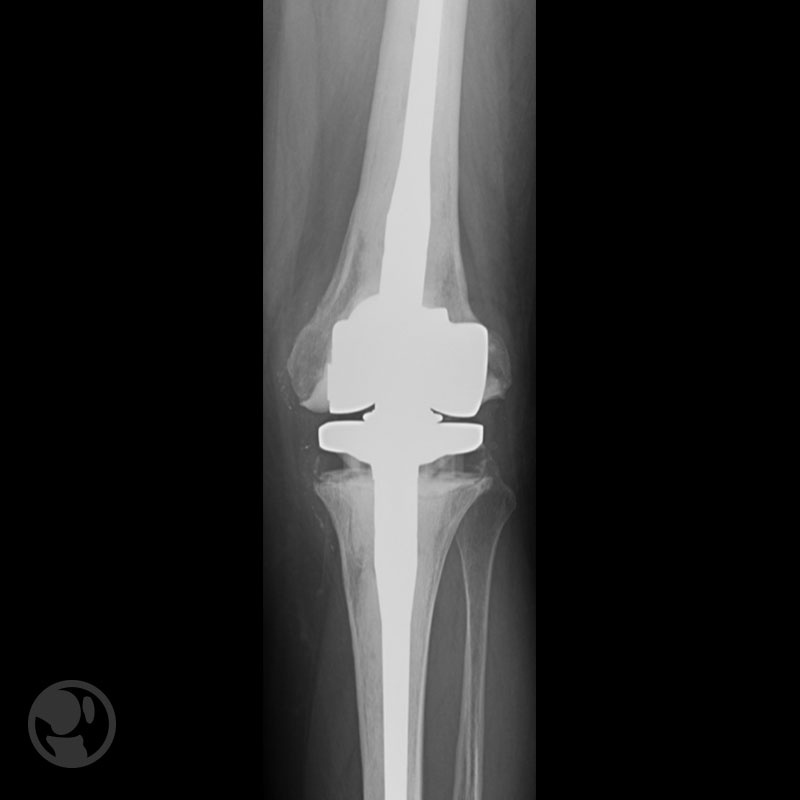
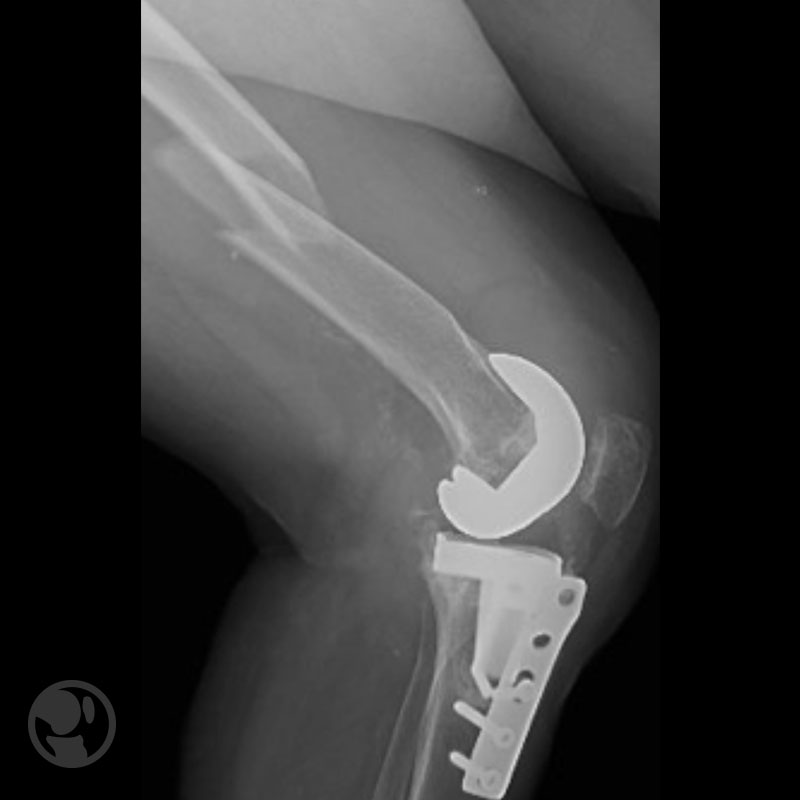
Fractura proximal a la punta del vástago tratada con placa LISS.
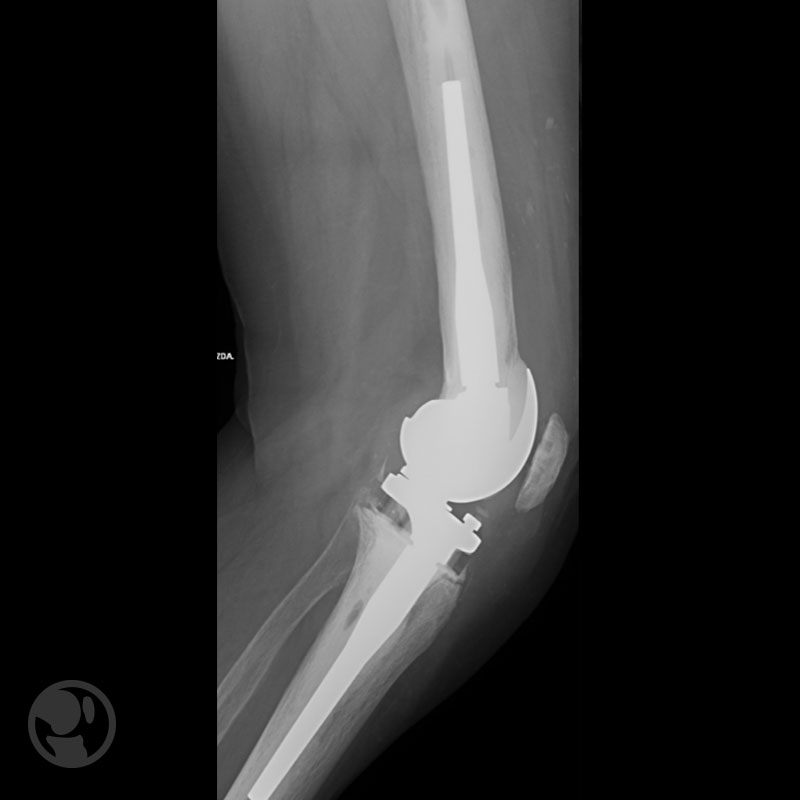
Fractura proximal a la punta del vástago tratada con placa LISS.
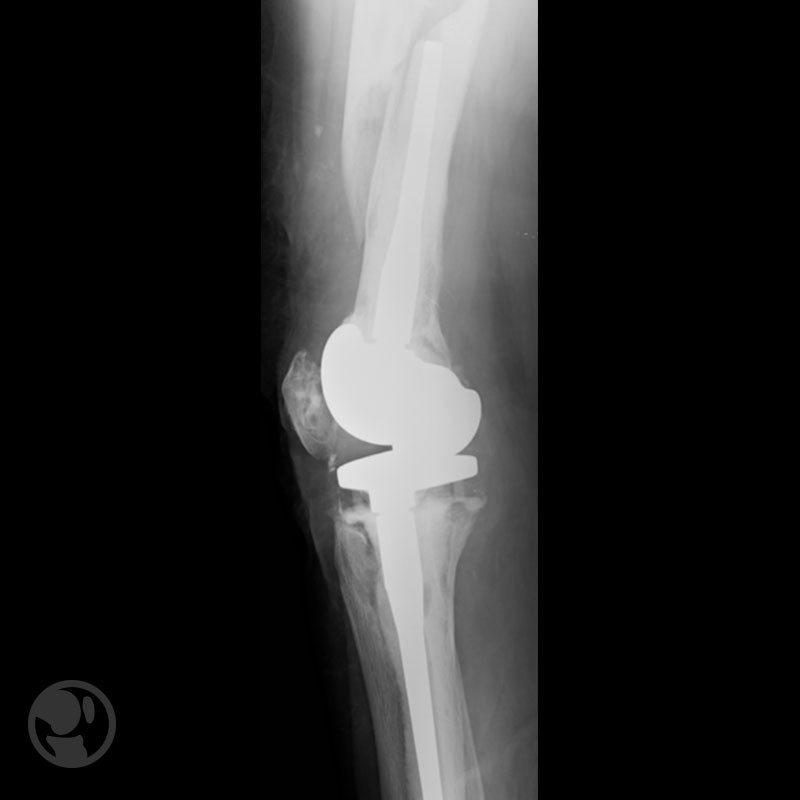
Fractura proximal a la punta del vástago tratada con placa LISS.
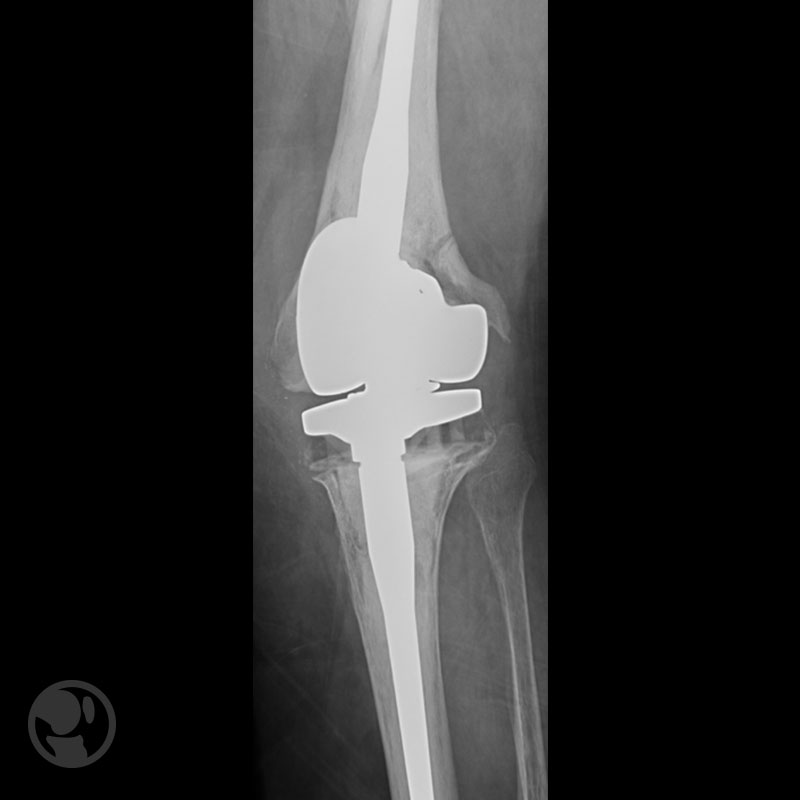
Fractura proximal a la punta del vástago tratada con placa LISS.
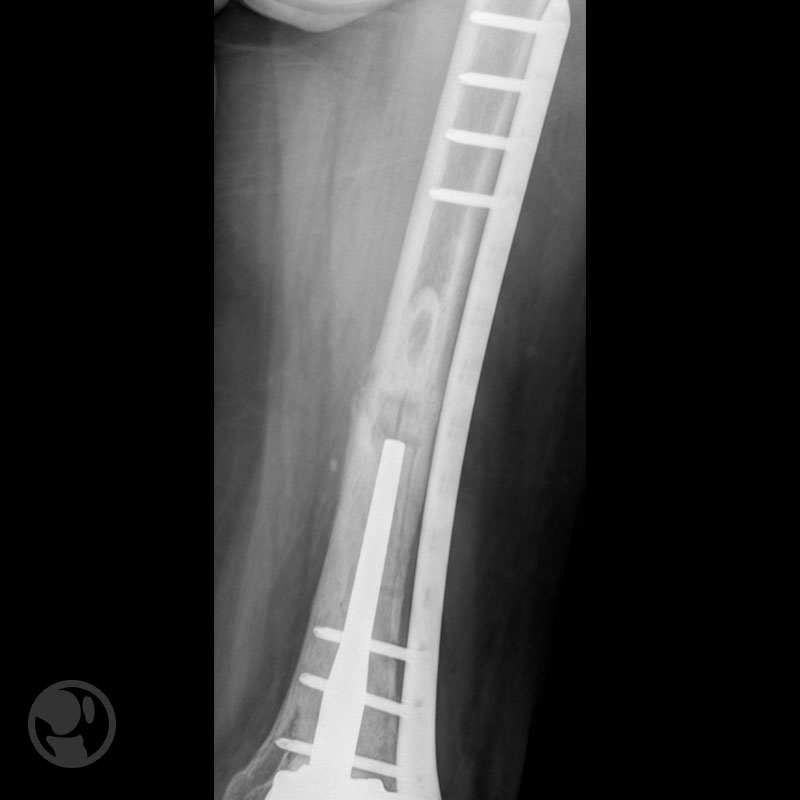
Fractura proximal a la punta del vástago tratada con placa LISS.
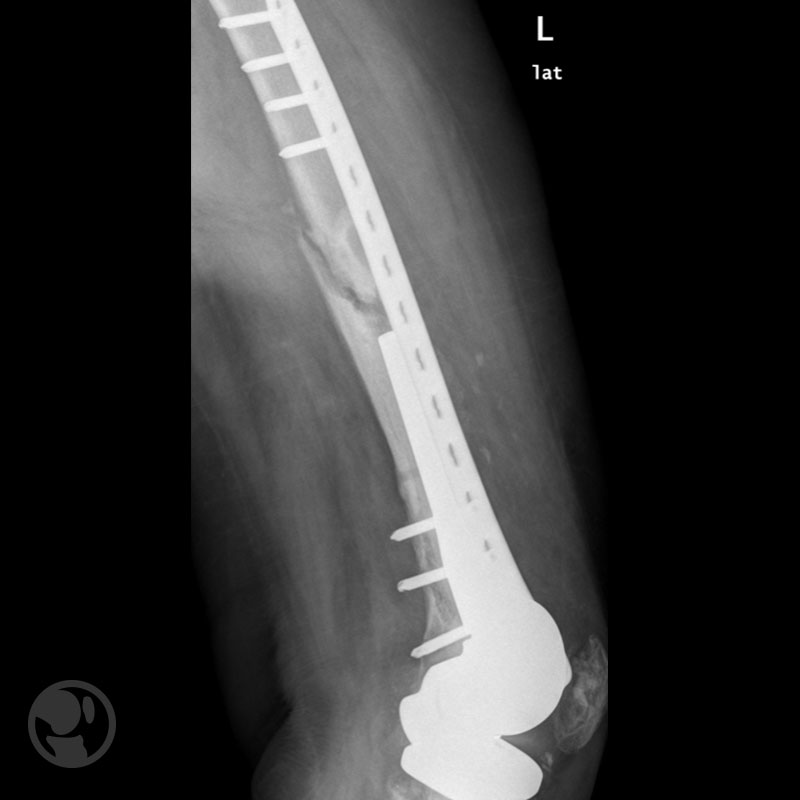
Fractura proximal a la punta del vástago tratada con placa LISS.
Las complicaciones de estos sistemas (29%) consisten en: fijación inestable en hueso osteoporótico, luxación, rotura del implante, aflojamiento de los tornillos y la prótesis, la pseudoartrosis y la infección.
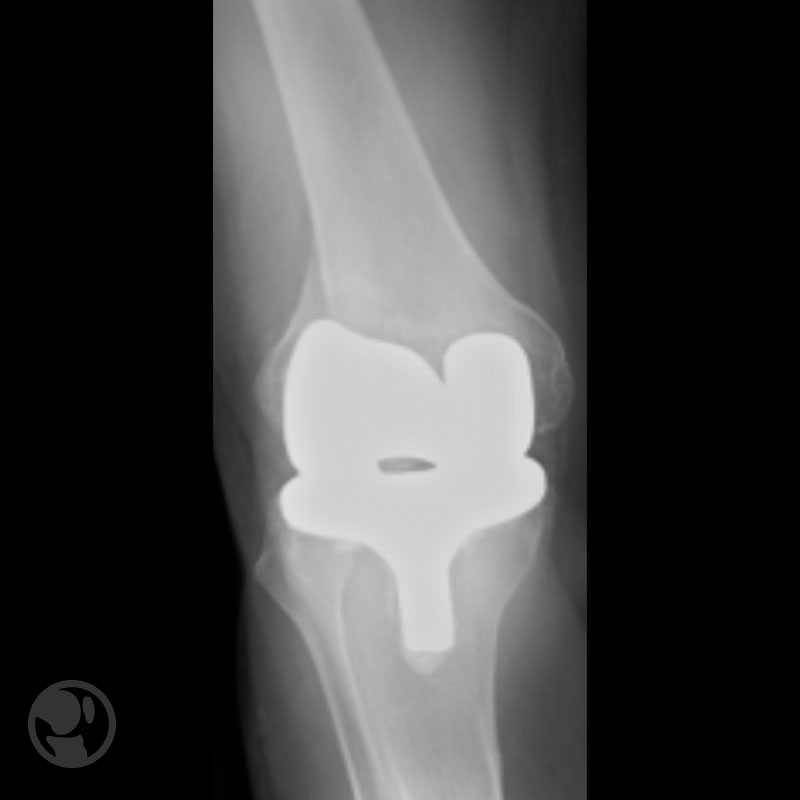
Pérdida de reducción por uso de implante de estabilidad angular inadecuado.
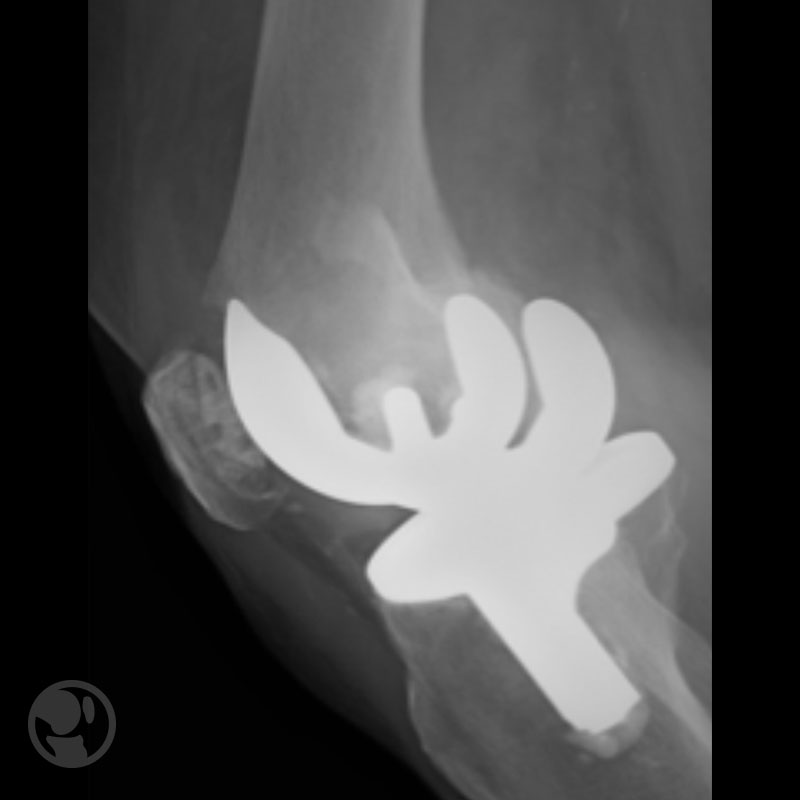
Pérdida de reducción por uso de implante de estabilidad angular inadecuado.
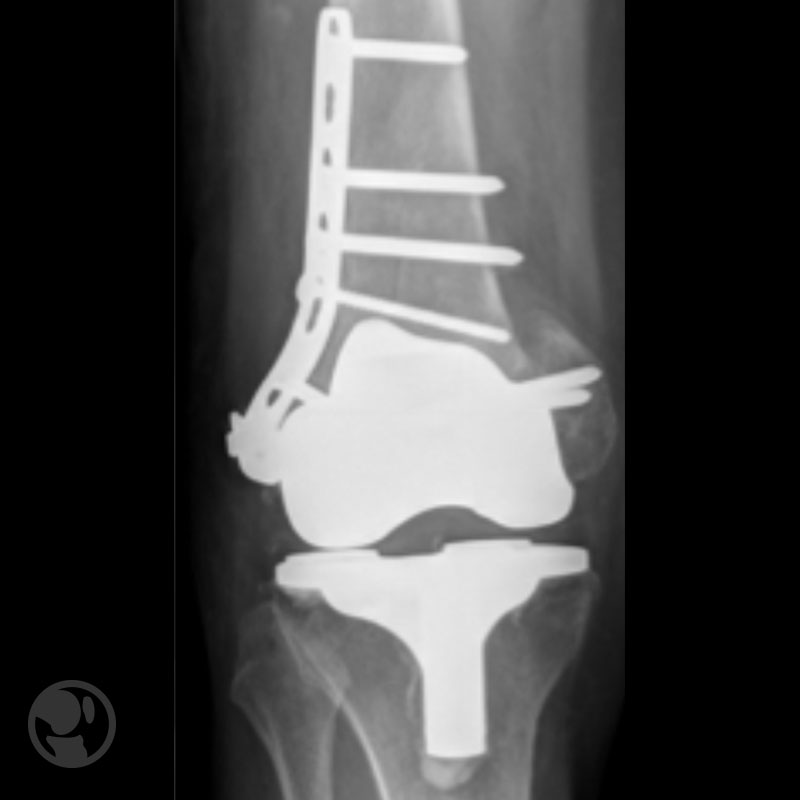
Pérdida de reducción por uso de implante de estabilidad angular inadecuado.
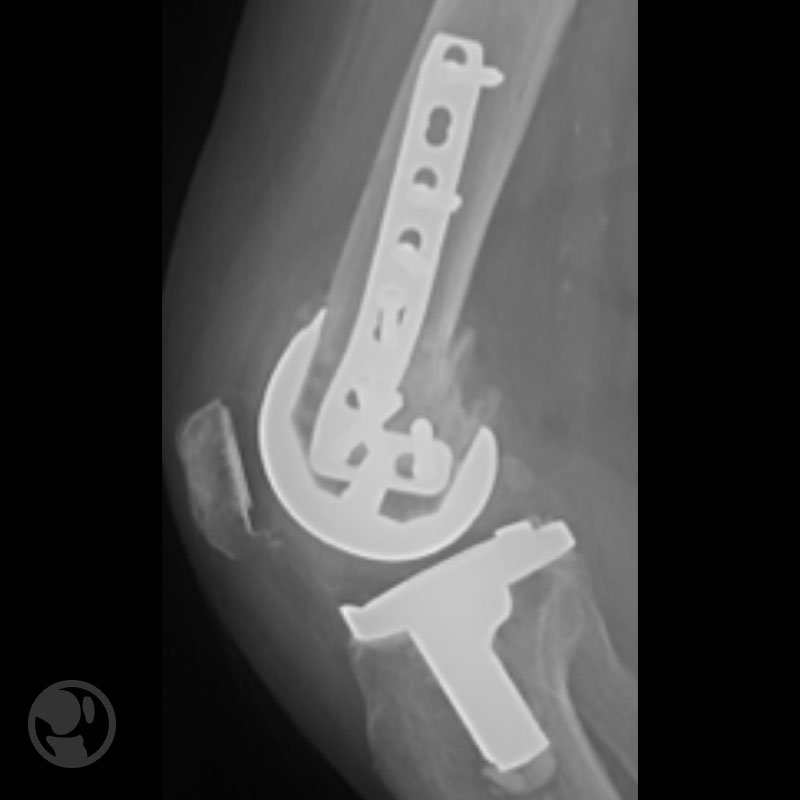
Pérdida de reducción por uso de implante de estabilidad angular inadecuado.
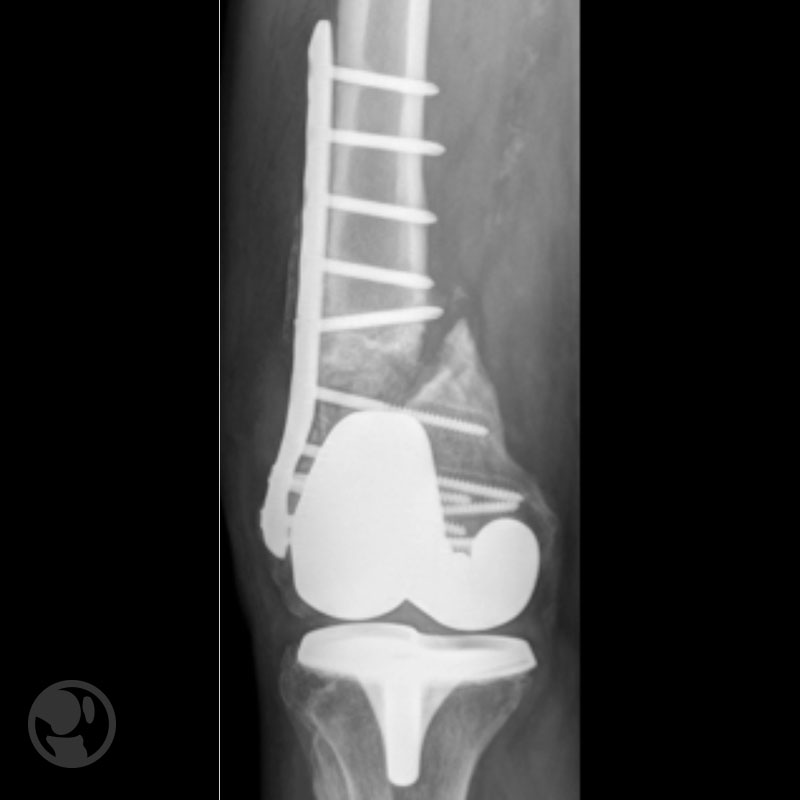
Pseudoartrosis por mala reducción y desmontaje por infección aguda en osteosíntesis con DCS
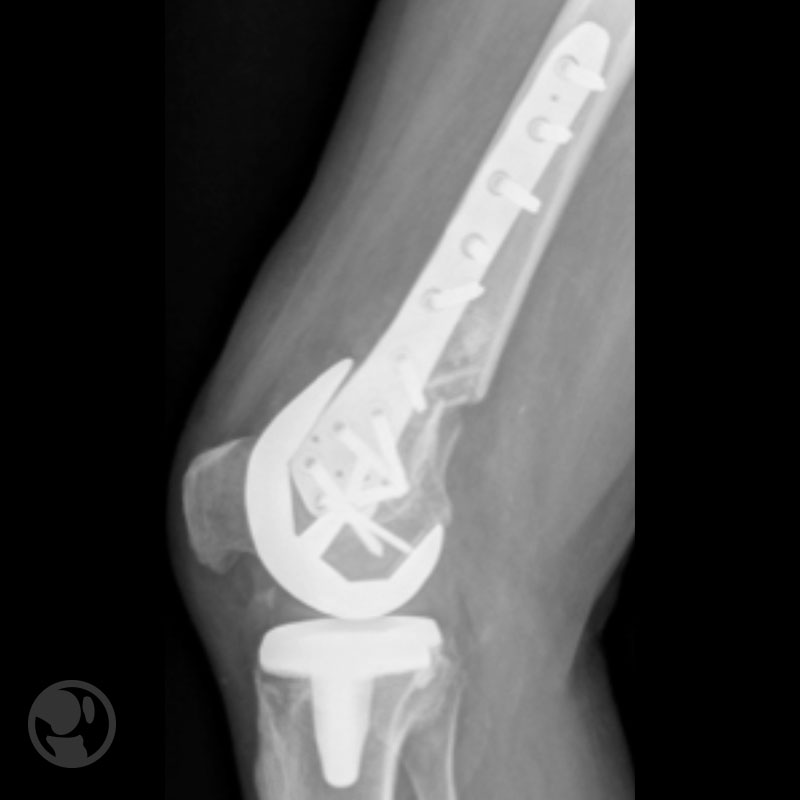
Pseudoartrosis por mala reducción y desmontaje por infección aguda en osteosíntesis con DCS
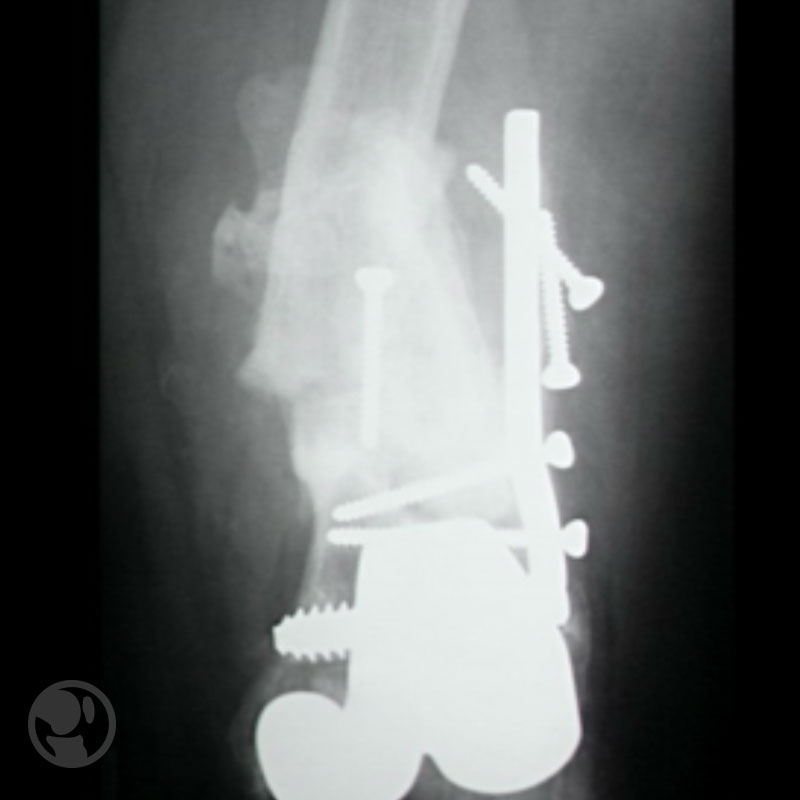
Pseudoartrosis por mala reducción y desmontaje por infección aguda en osteosíntesis con DCS
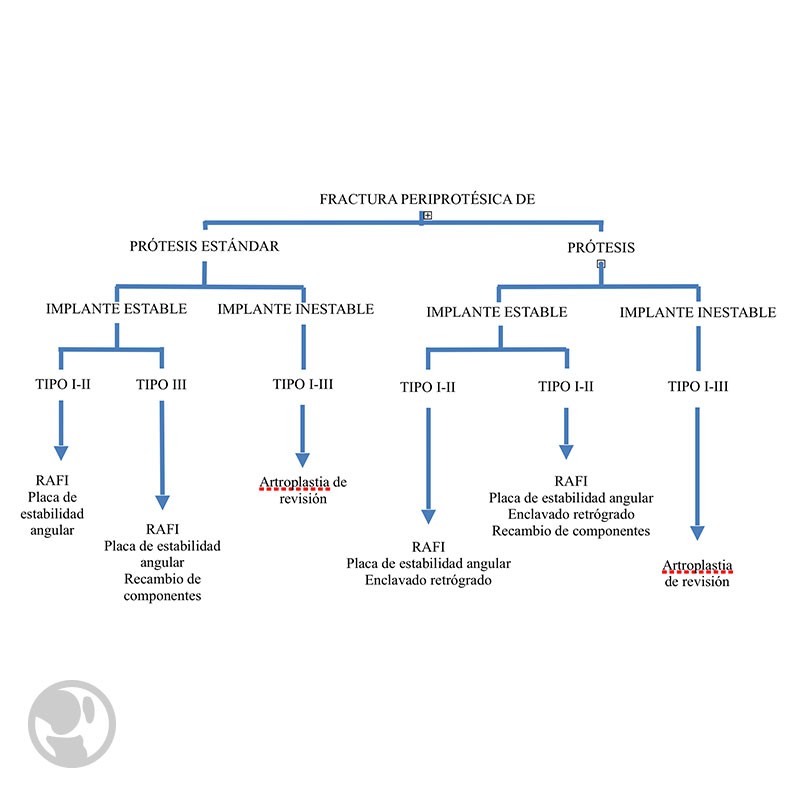
Algoritmo de tratamiento
Bibliografía
5. Merkel KD, Johnson Jr EW. Supracondylar fracture of the femur after total knee arthroplasty. J Bone Joint Surg Am 1986;68(1): 29–43.
6. Short WH, Hootnick DR, Murray DG. Ipsilateral supracondylar femur fractures following knee arthroplasty. Clin Orthop Relat Res 1981; 158:111–6.
7. Meek RM, Norwood T, Smith R et al. The risk of peri-prosthetic fracture after primary and revision total hip and knee replacement. J Bone Joint Surg Br 2011; 93: 96–101.
8. Grace JN, Sim FH. Fracture of the patella after total knee arthroplasty. Clin Orthop Relat Res. 1988;(230):168-75.
9. Cameron HU, Fedorkow DM. The patella in total knee arthroplasty. Clin Orthop Relat Res. 1982;(165):197-9.
10. Windsor RE, Scuderi GR, Insall JN. Patellar fractures in total knee arthroplasty. J Arthroplasty 1989;4(Suppl.): S63–7. 48.
11. Ortiguera CJ, Berry DJ. Patellar fracture after total knee arthroplasty. J Bone Joint Surg Am 2002; 84-A 4):532–40.
12. Scott RD, Turoff N, Ewald FC. Stress fracture of the patella following duopatellar total knee arthroplasty with patellar resurfacing. Clin Orthop Relat Res 1982; 170:147–51.
13. Keating EM, Haas G, Meding JB. Patella fracture after post total knee replacements. Clin Orthop Relat Res 2003; 416:93–7. 53.
14. Brick GW, Scott RD. The patellofemoral component of total knee arthroplasty. Clin Orthop Relat Res. 1988;(231):163-78.
15. Bourne RB. Fractures of the patella after total knee replacement. Orthop Clin North Am. 1999;30(2):287-91.
16. Chalidis BE, Tsiridis E, Tragas AA, Stavrou Z, Giannoudis PV. Management of periprosthetic patellar fractures. A systematic review of literature. Injury 2007;38(6):714–24.
17. Engh GA, Ammeen DJ. Periprosthetic fractures adjacent to total knee implants: treatment and clinical results. Instr Course Lect 1998;47:437–48.).
18. Hozack WJ, Goll SR, Lotke PA, Rothman RH, Booth Jr RE. The treatment of patellar fractures after total knee arthroplasty. Clin Orthop Relat Res 1988; 236:123–7.
19. Felix NA, Stuart MJ, Hanssen AD. Periprosthetic fractures of the tibia associated with total knee arthroplasty. Clin Orthop Relat Res 1997; 345:113–24.
20. Rand JA, Coventry MB. Stress fractures after total knee arthroplasty. J Bone Joint Surg Am 1980;62:226.).
21. Haidukewych GJ, Jacofsky DJ, Hanssen AD. Treatment of periprosthetic fractures around a total knee arthroplasty. J Knee Surg 2003;16(2):111–7.
22. Hanssen AD, Stuart MJ. Treatment of periprosthetic tibial fractures. Clin Orthop Relat Res 2000; 380:91–8.).
23. Sisto DJ, Lachiewicz PF, Insall JN. Treatment of supracondylar fractures following prosthetic arthroplasty of the knee. Clin Orthop Relat Res 1985;196: 265–72.
24. Chmell MJ, Moran MC, Scott RD. Periarticular fractures after total knee arthroplasty: principles of management. J Am Acad Orthop Surg 1996;4: 109.
25. Zalzal P, Backstein D, Gross AE, Papini M. Notching of the anterior femoral cortex during total knee arthroplasty characteristics that increase local stresses. J Arthroplasty 2006; 21(5):737–43.
26. Ritter MA, Thong AE, Keating EM, Faris PM, Meding JB, Berend ME, et al. The effect of femoral notching during total knee arthroplasty on the prevalence of postoperative femoral fractures and on clinical outcome. J Bone Joint Surg Am 2005; 87(11):2411–4.
27. Su ET, DeWal H, Di Cesare PE. Periprosthetic femoral fractures above total knee replacements. J Am Acad Orthop Surg 2004; 12(1):12–20.
28. Kregor PJ, Hughes JL, Cole PA. Fixation of distal femoral fractures above total knee arthroplasty utilizing the Less Invasive Stabilization System (L.I.S.S.). Injury 2001;32 (Suppl. 3):SC64–75.
29. Althausen PL, et al. Operative stabilization of supracondylar femur fractures above total knee arthroplasty: a comparison of four treatment methods. J Arthroplasty 2003;18:834.
30. Cordeiro EN, Costa RC, Carazzato JG, et al. Periprosthetic fractures in patients with total knee arthroplasties. Clin Orthop 1990; 252:182.




